Výpis souhrnů
Organická chemie
Podtémata
- Organická chemie
- Organická chemie obecně
- Úvod do organické chemie
- Zdroje organických látek (ropa, uhlí, zemní plyn)
- Reakce v organické chemii, indukční a mezomerní efekt
- Uhlovodíky
- Uhlovodíky: (cyklo)alkany/alkeny/alkyny
- Aromatické uhlovodíky
- Deriváty uhlovodíků
- Halogenderiváty a dusíkaté deriváty uhlovodíků
- Alkoholy, fenoly, ethery
- Aldehydy, ketony
- Karboxylové kyseliny
- Deriváty karboxylových kyselin
Organická chemie
 Organická chemie se zabývá složitějšími sloučeninami uhlíku (\mathrm{C}). Organické látky jsou základem živých organismů, člověk je také široce využívá např. jako fosilní paliva, léčiva či plasty.
Organická chemie se zabývá složitějšími sloučeninami uhlíku (\mathrm{C}). Organické látky jsou základem živých organismů, člověk je také široce využívá např. jako fosilní paliva, léčiva či plasty.
- Podtéma úvod do organické chemie přibližuje uhlík jakožto ústřední prvek organických látek, jeho chemické vazby a vzorce sloučenin.
- V podtématu zdroje organických látek lze procvičit informace o fosilních surovinách (ropa, uhlí, zemní plyn), s tím úzce souvisí i pohonné hmoty a doprava.
- Zejména na středoškolské úrovni je dobré mít přehled v pojmech týkajících se organických reakcí.
- Organické látky lze rozdělit na následující skupiny. V příslušných podtématech je možné procvičit jak obecné informace a souvislosti, tak názvosloví látek.
- Uhlovodíky – Obsahují pouze atomy uhlíku (\mathrm{C}) a vodíku (\mathrm{H}).
- Deriváty uhlovodíků – Atomy \mathrm{H} jsou v nich nahrazené jinými atomy či funkčními skupinami. Mezi deriváty uhlovodíků patří např. alkoholy či karboxylové kyseliny.
Organická chemie obecně
Toto téma poskytuje všeobecný počáteční přehled v organické chemii. Obsahuje tato podtémata:
- Úvod do organické chemie – Přibližuje uhlík jakožto základ organických sloučenin, chemické vazby uhlíku a vzorce sloučenin.
- Zdroje organických látek – Věnuje se surovinám, ze kterých se organické látky získávají.
- Reakce v organické chemii, indukční a mezomerní efekt – Pojmy spojené s reakcemi, typy reakcí a jejich ovlivňování navázanými skupinami.
Úvod do organické chemie
Organická chemie se zabývá organickými látkami. To jsou (většinou složitější) sloučeniny, jejichž základem je uhlík (\mathrm{C}), kromě něj obsahují i další prvky (\mathrm{H}, \mathrm{O}, \mathrm{N}, halogeny, \mathrm{S}…).
Výskyt organických sloučenin
Organické sloučeniny jsou zásadní součástí živých organismů, mohou tedy být přírodního původu. Zdrojem organických látek je např. biomasa, ropa, zemní plyn či uhlí. Většina známých organických sloučenin je uměle vyrobena (např. z výše uvedených zdrojů). Z organických látek sestávají třeba léčiva, plasty či pohonné hmoty.
Uhlík jako základ organických sloučenin
Atomy uhlíku mají 4 valenční elektrony, jsou 4vazné. Zároveň ochotně tvoří řetězce či cykly (kruhy), což dává vzniknout obrovskému množství organických sloučenin. Atomy uhlíku mohou tvořit jednoduché, dvojné i trojné vazby.
Vazby atomů C podrobněji
Jednoduchá vazba uhlíku je vazba σ, u té je elektronová hustota nejvyšší na spojnicích jader atomů účastnících se vazby. V případě dvojné vazby jde o vazbu σ a vazbu π (u vazby π se překrývají orbitaly mimo spojnici jader, tato vazba se ochotněji účastní reakcí), trojná vazba sestává z jedné vazby σ a dvou vazeb π.
Atomy uhlíku mají v základním stavu elektronovou konfiguraci \mathrm{[He]\;2s\,\boxed{\uparrow\downarrow} \;2p\,\boxed{\uparrow\;}\,\boxed{\uparrow\;}\,\boxed{\phantom{\uparrow\;}}}. Po excitaci jsou ve valenčních orbitalech k dispozici 4 nespárované elektrony pro tvorbu kovalentních vazeb. U valenčních orbitalů dochází ke sjednocování energií (a tvarů), tzv. hybridizaci:
Při hybridizaci \mathrm{sp^3} se sjednotí všechny valenční orbitaly: \mathrm{[He]}\;\textcolor{#16a085}{2\mathrm{s}\,\boxed{\uparrow\;}\;2\mathrm{p}_{x, y, z}\boxed{\uparrow\; }\,\boxed{\uparrow\;}\,\boxed{\uparrow\;}}. Vznikající (jednoduché) vazby jsou pak rovnocenné a jejich vrcholy tvoří čtyřstěn (tetraedr). Tato hybridizace se vyskytuje např. v molekule methanu:
Při hybridizaci \mathrm{sp^2} je stav orbitalů následující: \mathrm{[He]}\;\textcolor{#16a085}{\mathrm{2s},2\mathrm{p}_x, 2\mathrm{p}_y\,\boxed{\uparrow\;}\,\boxed{\uparrow\;}\,\boxed{\uparrow\;}}\;2\mathrm{p}_{z}\boxed{\uparrow\;}. Vznikají dvě jednoduché vazby a jedna dvojná, jejich vrcholy vytvářejí (rovnostranný) trojúhelník. Tuto hybridizaci má uhlík např. v molekule ethenu:
Hybridizaci \mathrm{sp} lze znázornit takto: \mathrm{[He]}\;\textcolor{#16a085}{\mathrm{2s},2\mathrm{p}_x \,\boxed{\uparrow\;}\,\boxed{\uparrow\;}}\;2\mathrm{p}_y,2\mathrm{p}_{z}\boxed{\uparrow\;}\,\boxed{\uparrow\;}. Dochází ke vzniku jednoduché a trojné vazby, nebo dvou dvojných vazeb. Tvar je lineární. Příkladem je ethyn:
Typy vzorců
Stavbu molekul organických sloučenin vyjadřují zejména následující typy vzorců. Jako příklad je vždy uveden vzorec propan-1-olu.
- strukturní – Znázorňuje konkrétní uspořádání atomů v molekule. Ve vzorci mohou být explicitně zobrazené vazby atomů vodíku (vlevo), značka uhlíku se mnohdy pro zjednodušení vynechává (vpravo):
- racionální – Ukazuje navázání (funkčních) skupin atomů:
- sumární – Udává celkové počty atomů jednotlivých prvků:
Izomerie u organických látek
Látky, které se skládají ze stejných částic (tedy mají stejné sumární vzorce), mohou tyto částice (a vazby mezi nimi) mít různě rozmístěné. Poté se jedná o izomery. Izomery vznikají i u anorganických látek, ale pro organické látky jsou vyloženě typické.
- Konstituční (strukturní) izomery (a) se liší pořadím atomů/vazeb (např. ethanol a dimethylether).
- Konfigurační izomery (stereoizomery) se liší prostorovým uspořádáním atomů:
- Cis/trans izomerie (b) se týká substituentů u dvojných vazeb (např. cis- a trans-but-2-en) nebo na cyklických strukturách. Energeticky výhodnější je trans izomerie, kde se substituenty vzájemně tolik neovlivňují.
- Optická izomerie (c) souvisí s tím, že některé molekuly jsou navzájem svými „zrcadlovými obrazy“. Optické izomery (enantiomery) jinak stáčejí rovinu polarizovaného světla. Asymetrie vzniká na tzv. stereocentrech, což jsou v případě organických sloučenin obvykle asymetrické uhlíky, na něž jsou navázány 4 různé substituenty.
- Konformery (d) se liší pouze rotací součástí molekul kolem jednoduché vazby (např. u ethanu, nezákrytová konformace je energeticky výhodnější) či více jednoduchých vazeb (např. u cyklohexanu).
Zdroje organických látek (ropa, uhlí, zemní plyn)
Mezi zdroje organických látek patří například biomasa, uhlí, ropa či zemní plyn.
Biomasa
Jako biomasa se označuje souhrn látek tvořících živé organismy. Dále uvedené fosilní zdroje organických látek vznikly její přeměnou.
Uhlí
Uhlí vzniklo za nepřístupu vzduchu ze zbytků rostlin, které se hromadily v močálech a jezerních pánvích.
- Černé uhlí pochází zejména z karbonu (to je perioda prvohor), v této době se zdejší území nacházelo na rovníku a rostly zde „lesy“ plavuní, přesliček a kapradin. Černé uhlí se donedávna těžilo hloubkově v ostravsko-karvinské pánvi (těžba byla ukončena v únoru 2026). Z černého uhlí se vyrábí koks pro výrobu železa. Z černouhelného dehtu, což je odpadní produkt výroby koksu, lze získávat zejména aromatické uhlovodíky.
- Hnědé uhlí v Česku pochází z neogénu („mladší třetihory“), vzniklo mj. z jehličnanů a listnatých stromů. Těží se povrchově v mostecké, chebské či sokolovské pánvi. Používá se zejména pro provoz tepelných elektráren.
Ropa
Vznikla z mořských mikroorganismů (řas a živočišného planktonu). V Česku jsou jí pouze malé zásoby. Ropa se dováží do Česka prostřednictvím ropovodu IKL z Německa, ten je pokračováním Transalpine Pipeline (TAL). Ropovod TAL začíná v italském Terstu, sem se dováží ropa tankery hlavně z arabských zemí.
Ropovod Družba
Dovoz ropy z Ruska ropovodem Družba byl značně omezen po invazi na Ukrajinu v roce 2022. Od března 2025 se jím do Česka už ropa už vůbec nedodává.
Ropa se nachází pod vrstvami nepropustných hornin, těží se jak na pevnině, tak na moři. Havárie ropných plošin (ale i tankerů) mají značně negativní vliv na životní prostředí.
Ropa je směs, především z uhlovodíků. Jednotlivé složky ropy se oddělují pomocí frakční destilace (respektive přesněji kontinuální rektifikace) na základě rozdílných teplot varu. Frakční destilací (a případnými dalšími úpravami) se získává např. propan-butan, benzin, petrolej, motorová nafta či asfalt. Z ropy též lze oddělit např. benzen, ethen, propen aj.
Zemní plyn
Zemní plyn obsahuje methan (\mathrm{CH_4}) a další těkavé uhlovodíky s krátkým uhlíkovým řetězcem. Mnohdy doprovází ložiska ropy či uhlí. V Evropě se těží v Norsku, dováží se např. z Ruska, Alžírska, ve formě LNG (zkapalněného zemního plynu) ze Spojených států.
NahoruReakce v organické chemii, indukční a mezomerní efekt
Organické látky podléhají určitým typům reakcí.
Typy reagujících částic a jejich vznik
Pokud je reagující částice elektrofilní, vyhledává záporný náboj a je kladně nabitá (např. \mathrm{NO_2^+}, \mathrm{Br^+}, \mathrm{H_3O^+}). Nukleofilní částice vyhledává kladný náboj a bývá nabitá záporně, případně obsahuje volný elektronový pár (např. \mathrm{Cl^-}, \mathrm{NH_3}). Mnohé elektrofilní či nukleofilní částice vznikají při heterolytickém štěpení vazeb, schematicky \mathrm{AB \longrightarrow A^+ + B^-}.
Radikál je velmi reaktivní částice, má jeden či více nespárovaných elektronů. Radikály vznikají při homolytickém štěpení, schematicky \mathrm{AB \longrightarrow A\!\boldsymbol{\cdot} + B\boldsymbol{\cdot}}.
Typy reakcí
- Adice je navázání (přidání) atomů či skupin do molekuly. Konkrétními příklady jsou hydrogenace (adice vodíku), hydratace (adice vody) či halogenace (adice halogenu). Aby mohla adice proběhnout, musí v molekule být přítomna násobná vazba. Násobnost této vazby se adicí snižuje (zvyšuje se nasycenost).
- Eliminace je odstranění částic z molekuly. Při eliminaci vzniká násobná vazba mezi atomy C či se zvětšuje její násobnost (snižuje se nasycenost).
- Substituce je nahrazení atomu či skupiny jiným atomem/skupinou.
- Izomerace (někdy též přesmyk) je změna uspořádání částic v rámci molekuly, vznikají při ní izomery.
- Oxidace zahrnuje zvyšování oxidačního čísla, v organické chemii obvykle souvisí s přidáním kyslíku a/nebo odebráním vodíku. Redukce souvisí se snižováním oxidačního čísla, obvykle odebráním kyslíku a/nebo přidáním vodíku.
Indukční a mezomerní efekt
Indukční a mezomerní efekt způsobují změnu elektronové hustoty a tím ovlivňují průběh chemických reakcí.
- Indukční efekt souvisí s posunem elektronové hustoty po σ vazbách. Atomy s vysokou elektronegativitou (např. O, F) snižují elektronovou hustotu na sousedních atomech, mají tedy záporný indukční efekt (−I). Naopak atomy s nízkou elektronegativitou (např. Mg, Li) mají indukční efekt kladný (+I), elektronovou hustotu na sousedních atomech zvyšují.
- Mezomerní efekt souvisí s posunem elektronové hustoty u π vazeb (násobných vazeb) a volných elektronových párů. Uplatňuje se např. u substituovaného aromatického jádra. Substituenty snižující hustotu π elektronů v konjugovaném systému mají záporný (−M) mezomerní efekt. Substituenty, které tuto hustotu zvyšují, mají mezomerní efekt kladný (+M).
Uhlovodíky
Uhlovodíky jsou organické sloučeniny obsahující pouze atomy uhlíku (\mathrm{C}) a vodíku (\mathrm{H}). Jsou součástí fosilních surovin (zemního plynu, ropy), používají se např. k výrobě plastů či jako rozpouštědla.
Uhlovodíky se podle typu uhlíkového řetězce rozdělují na:
- alifatické – (Cyklo)alkany/alkeny/alkeny.
- acyklické – Uhlíkový řetězec je lineární (přímý) nebo rozvětvený, patří sem mj. alkany, alkeny a alkyny.
- cyklické – Uhlíkový řetězec je uspořádaný do cyklu (kruhu). Náleží sem cykloalkany, cykloalkeny a cykloalkyny.
- aromatické – Obsahují aromatické jádro – systém delokalizovaných π vazeb (např. benzen).
Procvičování informací o výše zmíněných skupinách uhlovodíků pohromadě nabízí téma uhlovodíky: mix.
Tipy k procvičování
Rozhodovačky nabízejí procvičování obecných informací/souvislostí o uhlovodících. Ve cvičeních otázky, překladatel a pexeso lze trénovat názvosloví. Co se názvosloví týče, pro 2. stupeň ZŠ/NG jsou vhodné lehké úrovně cvičení.
Uhlovodíky: (cyklo)alkany/alkeny/alkyny
Uhlovodíky jsou organické sloučeniny obsahující atomy uhlíku (C) a vodíku (H). Tato kapitola se věnuje acyklickým uhlovodíkům (s lineárními či rozvětvenými řetězci) a uhlovodíkům cyklickým (ty mají uhlíkové řetězce uzavřené do kruhu, ale nejsou aromatické).
Názvosloví uhlovodíků v základu využívá kořen slova odpovídající počtu atomů C:
| Počet atomů C | Uhlovodík |
|---|---|
| 1 | methan |
| 2 | ethan |
| 3 | propan |
| 4 | butan |
| 5 | pentan |
| 6 | hexan |
| 7 | heptan |
atd.
Koncovka poté odráží přítomnost určitých vazeb:
| Vazba | Koncovka |
|---|---|
| jednoduchá | -an |
| jedna dvojná | -en |
| jedna trojná | -yn |
Alkany, cykloalkany
V molekulách obsahují jednoduché vazby mezi atomy C. Jejich body varu rostou se stoupající molekulovou hmotností.
- methan (\mathrm{CH_4}) – Nejjednodušší uhlovodík. Hlavní součást zemního plynu, spalováním za účasti kyslíku vzniká jen \mathrm{CO_2} a \mathrm{H_2O}. V přírodě vzniká např. při hnilobných procesech, podílí se na skleníkovém efektu.
- propan (\mathrm{C_3H_8}), butan (\mathrm{C_4H_{10}}) – Směs se používá v tlakových nádobách na vaření, méně často jako palivo (LPG = liquefied petroleum gas).
- cyklohexan (\mathrm{C_6H_{12}}) – Nepolární rozpouštědlo.
Mezi významné reakce těchto látek patří radikálová substituce (vznik radikálů je iniciován např. UV zářením), či dehydrogenace za vzniku násobných vazeb mezi atomy C.
Uhlovodíky s dvojnými vazbami
Uhlovodíky s jednou vazbou mezi atomy C jsou alkeny či cykloalkeny. Pokud je dvojných vazeb více, označuje se tato skutečnost předponou (např. buta-1,3-dien).
- ethen (\mathrm{{H_2C\!=\!CH_2}}) – Rostlinný hormon (podporuje např. dozrávání plodů), polymerací vzniká plast polyethylen (PE).
Významnými reakcemi uhlovodíků s dvojnou vazbou jsou adice (elektrofilní či radikálová) či polymerace.
Uhlovodíky s trojnými vazbami
Je-li v molekule jedna trojná vazba, jedná se o alkyny či cykloalkyny.
- ethyn (\mathrm{{HC\!≡\!CH}}) – Má uplatnění v chemické syntéze. Hoří za vysoké teploty, používá se ke sváření (autogen) a řezání kovů.
Typické reakce uhlovodíků s trojnými vazbami jsou adice, hydrogenace či polymerace.
NahoruAromatické uhlovodíky
Aromatické uhlovodíky (areny) obsahují aspoň jedno aromatické jádro – delokalizovaný systém π elektronů. Zjednodušeně řečeno: elektrony, které by za normálních okolností tvořily část dvojné vazby na určitém místě, jsou rovnoměrně rozprostřeny v kruhu. To zajišťuje aromatickým uhlovodíkům mimořádnou stálost.
Znázornění aromatického jádra
Vzorce níže znázorňují jednu a tu samou molekulu, elektrony tvořící π vazby nejsou vázané na konkrétní místa.
Aromatické jádro se někdy zobrazuje jako šestiúhelník s kruhem uprostřed, to je ovšem nevýhodné při uvažování o posunu elektronů v rámci chemických reakcí.
Areny obvykle mají specifický zápach. Bývají velmi těkavé (to je někdy výhodné, když se používají jako rozpouštědla), zároveň bývají nebezpečné pro zdraví.
Příklady aromatických uhlovodíků
| Název | Vzorec | Informace |
|---|---|---|
| benzen |  |
Bezbarvá kapalina, toxická, karcinogenní. Nepolární rozpouštědlo. |
| methylbenzen (triviálně toluen) |  |
Aromatické jádro s navázanou methylovou skupinou, poněkud méně toxický než benzen. Rozpouštědlo. Zneužíván jako inhalační droga. |
| ethenylbenzen (triviálně styren) |  |
Jeho polymerací vzniká plast polystyren. |
| naftalen |  |
Bílá krystalická pevná látka s typickým zápachem, dříve používán k hubení/odpuzování molů. |
Při hoření organických látek mohou vznikat polycyklické aromatické uhlovodíky (např. benzo[a]pyren sestávající z pěti aromatických jader). Tyto látky jsou značně nebezpečné pro zdraví, nacházejí se např. v cigaretovém kouři, spalinách z dopravních prostředků (jsou součástí smogu) či v grilovaných/připálených potravinách.
Reakce aromatických uhlovodíků
Typickou reakcí aromatických uhlovodíků je elektrofilní substituce (dochází k náhradě H na aromatickém jádře).
Deriváty uhlovodíků
Deriváty uhlovodíků jsou odvozené z uhlovodíků. Vznikají tak, že dojde k nahrazení atomu (či atomů) vodíku (\mathrm{H}) jinými atomy nebo funkčními skupinami. Některé jsou připravované uměle (třeba halogenderiváty), jiné jsou běžnou součástí živých organismů (zejména deriváty obsahující kyslík).
K dispozici jsou následující podtémata:
- Halogenderiváty a dusíkaté deriváty
- Halogenderiváty obsahují halogeny (nejčastěji \mathrm{Cl}, \mathrm{F}), příkladem je tetrafluorethen k výrobě teflonu.
- Dusíkaté deriváty zahrnují zejména aminy (primární obsahují skupinu \mathrm{–NH_2}, např. benzenamin = anilin). Nitrosloučeniny obsahují skupinu \mathrm{–NO_2}, např. 2,4,6-trinitrotoluen – TNT.
- Alkoholy, fenoly, ethery – Alkoholy a fenoly obsahují hydroxylovou skupinu (\mathrm{–OH}). Příkladem alkoholů je ethanol (líh). Ethery obsahují atom \mathrm{O} v uhlíkovém řetězci (\mathrm{–O–}).
- Aldehydy, ketony – Obsahují karbonylovou skupinu (\mathrm{C\!=\!O}). Příkladem aldehydů je methanal (formaldehyd), mezi ketony patří třeba propan-2-on (aceton).
- Karboxylové kyseliny – Obsahují karboxylovou skupinu (\mathrm{-COOH}). Příkladem je kyselina ethanová (octová) či citronová.
- Deriváty karboxylových kyselin – Vznikají buď nahrazeními na karboxylové skupině (funkční deriváty), nebo na uhlíkovém řetězci (substituční deriváty).
- Deriváty uhlovodíků: mix
Halogenderiváty a dusíkaté deriváty uhlovodíků
Deriváty uhlovodíků jsou odvozené z uhlovodíků. Vznikají tak, že dojde k nahrazení atomu (či atomů) vodíku (H) jinými atomy nebo funkčními skupinami.
Halogenderiváty
Halogenderiváty uhlovodíků ve svých molekulách obsahují atomy halogenů (\mathrm{F}, \mathrm{Cl}, \mathrm{Br} či \mathrm{I}). Živé organismy je vytvářejí jen velmi vzácně, většina je jich uměle vyrobena. Některé jsou netečné a víceméně zdravotně nezávadné, jiné jsou nebezpečné pro zdraví či dráždivé. Mnohé halogenderiváty patří mezi „věčné chemikálie“, v přírodě se prakticky nerozkládají a dlouhodobě ji znečišťují. Halogenderiváty na druhou stranu mnohdy mívají nezastupitelné a žádané vlastnosti.
Dále uvádíme příklady halogenderivátů:
- freony
- Různé komerčně vyráběné látky, které obsahují ve svých molekulách \mathrm{F} a \mathrm{Cl}.
- Dříve využívané freony (obsahující \mathrm{Cl}, např. R12 – difluordichlormethan) měly uplatnění v chladicích zařízeních a jako hnací látky do sprejů. Poškozovaly ovšem ozonovou vrstvu, od jejich používání se upustilo.
- V současnosti se v EU jako chladivo do klimatizací dopravních prostředků používá např. R-1234yf (2,3,3,3-tetrafluorpropen).
- tetrafluorethen
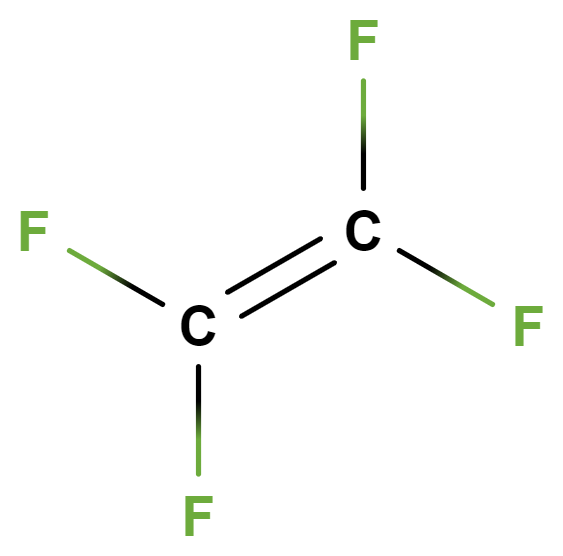
- Jeho polymerací (zřetězením molekul) vzniká polytetrafluorethen (PTFE, komerčně teflon), který se využívá např. na nepřilnavé povrchy pánví, výrobě lyžařských vosků či nepromokavých membrán do oblečení a obuvi (odpuzuje vodu). Je nehořlavý a žáruvzdorný (taje při 327 °C).
Teflon: máme se ho bát?
- Teflon sám o sobě je relativně chemicky stálý. Zdravotní riziko může plynout z jeho přehřívání (nad 260 °C), při kterém vznikají nebezpečné plyny.
- Povrch teflonových pánví se časem poškrábe, což vede k uvolňování malých částic do pokrmů.
- Při výrobě teflonu se používají další fluorované látky, které jsou toxické/nebezpečné pro zdraví. Dříve šlo o PFOA = perfluorooktanovou kyselinu, dnes jde např. látku s označením FRD-903. Teflon i doprovodné látky se v přírodě prakticky nerozkládají a předávají se v rámci potravních řetězců.
- chlorethen (vinylchlorid)
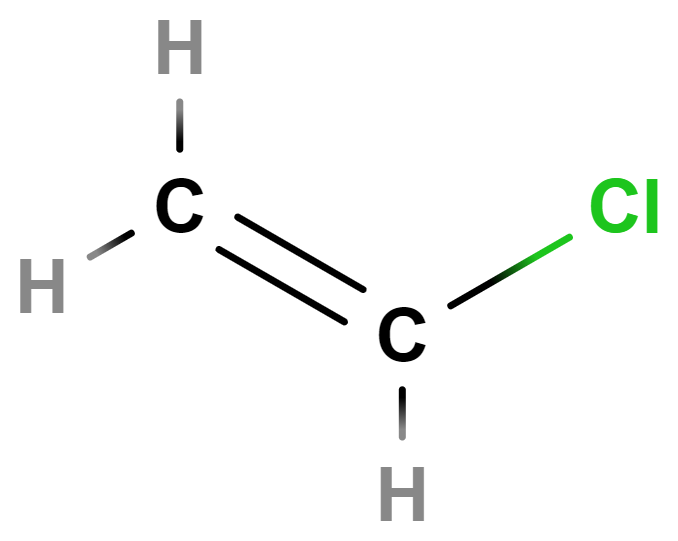
- Jeho polymerací vzniká plast PVC (polyvinylchlorid). Ten se těžko recykluje a při jeho hoření vznikají jedovaté zplodiny. Nachází nicméně využití při výrobě izolací kabelů, umělých linoleí, jednorázových rukavic či vinylových desek (gramodesek).
- tetrachlorethen (perchlorethylen)
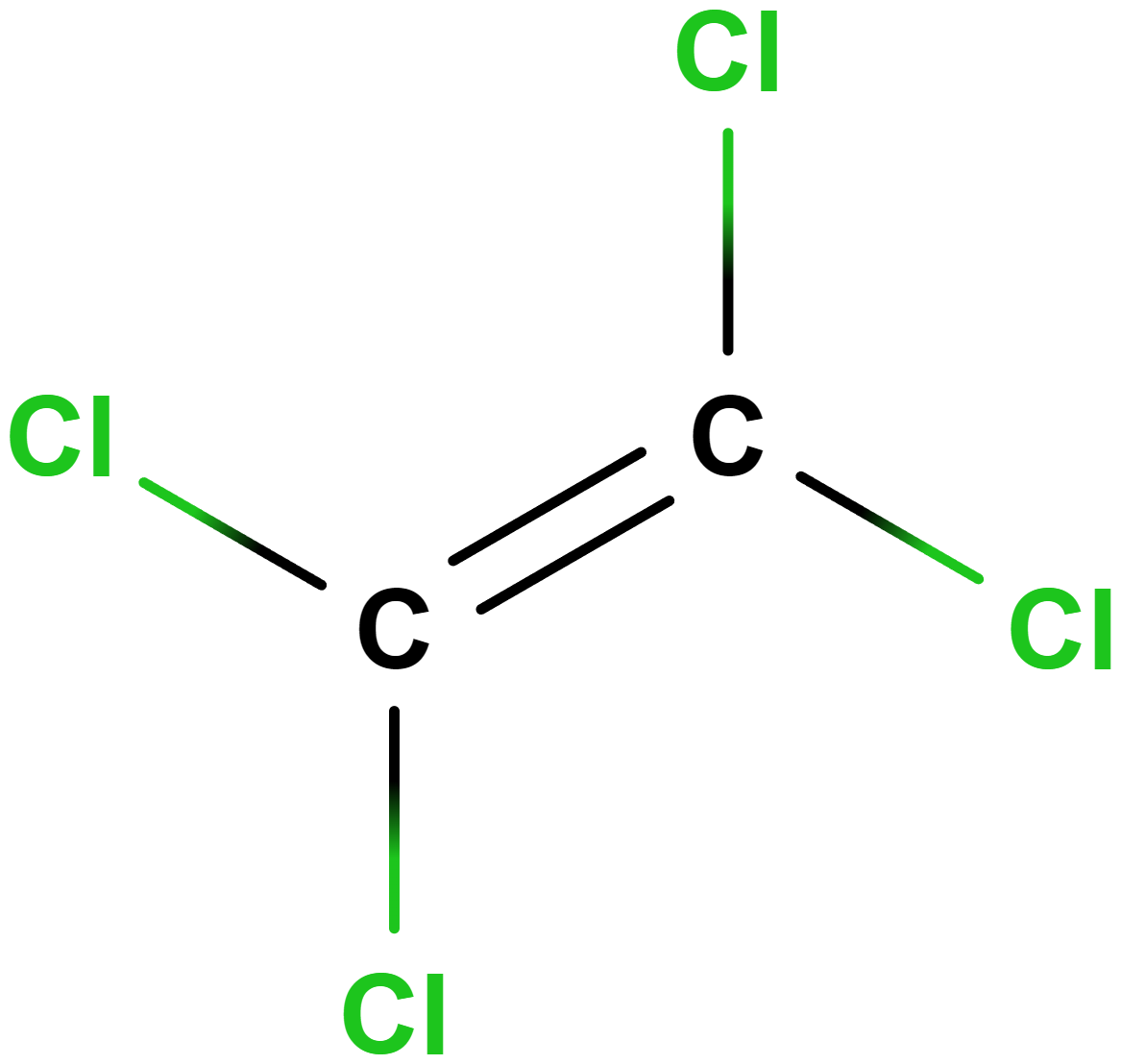
- Používá se pro suché čištění oblečení v čistírnách, dobře rozpouští tuky a další nečistoty.
- trichlormethan (chloroform)
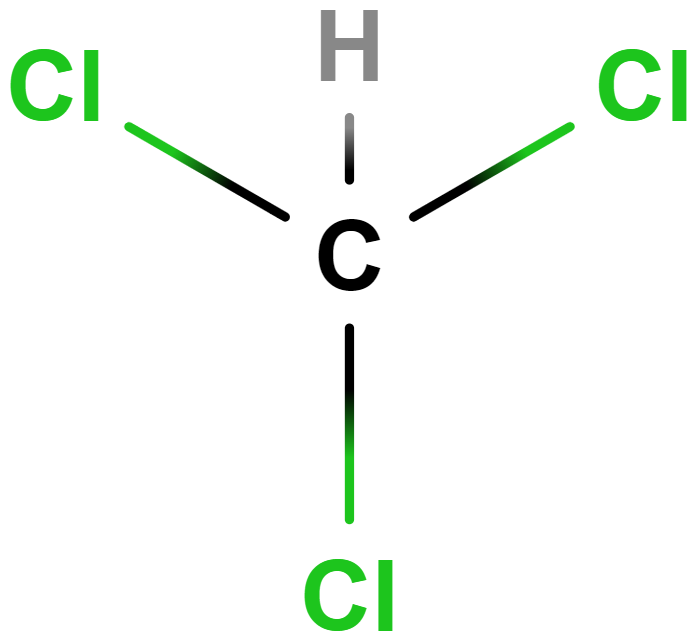
- Dříve využíván jako anestetikum, dnes v chemické syntéze nebo jako rozpouštědlo.
Dusíkaté deriváty uhlovodíků
Mezi dusíkaté deriváty uhlovodíků patří mj. aminoderiváty a nitroderiváty.
Aminoderiváty neboli aminy obsahují v molekulách skupinu \mathrm{–NH_2}. Patří mezi ně např. anilin (vzorec níže), z něhož se syntetizují barviva či léčiva.
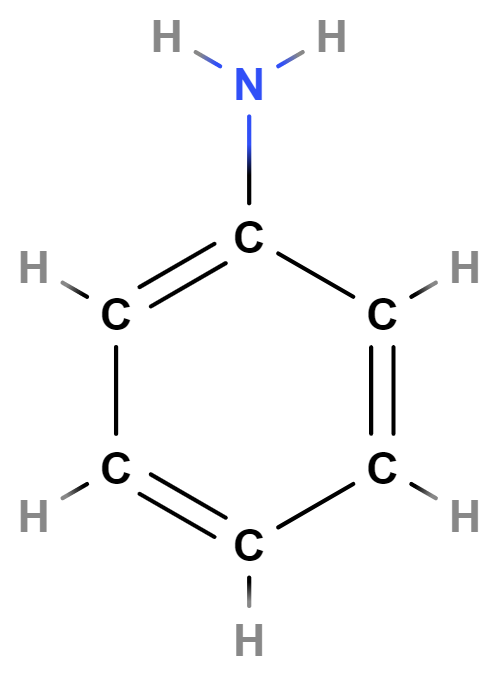
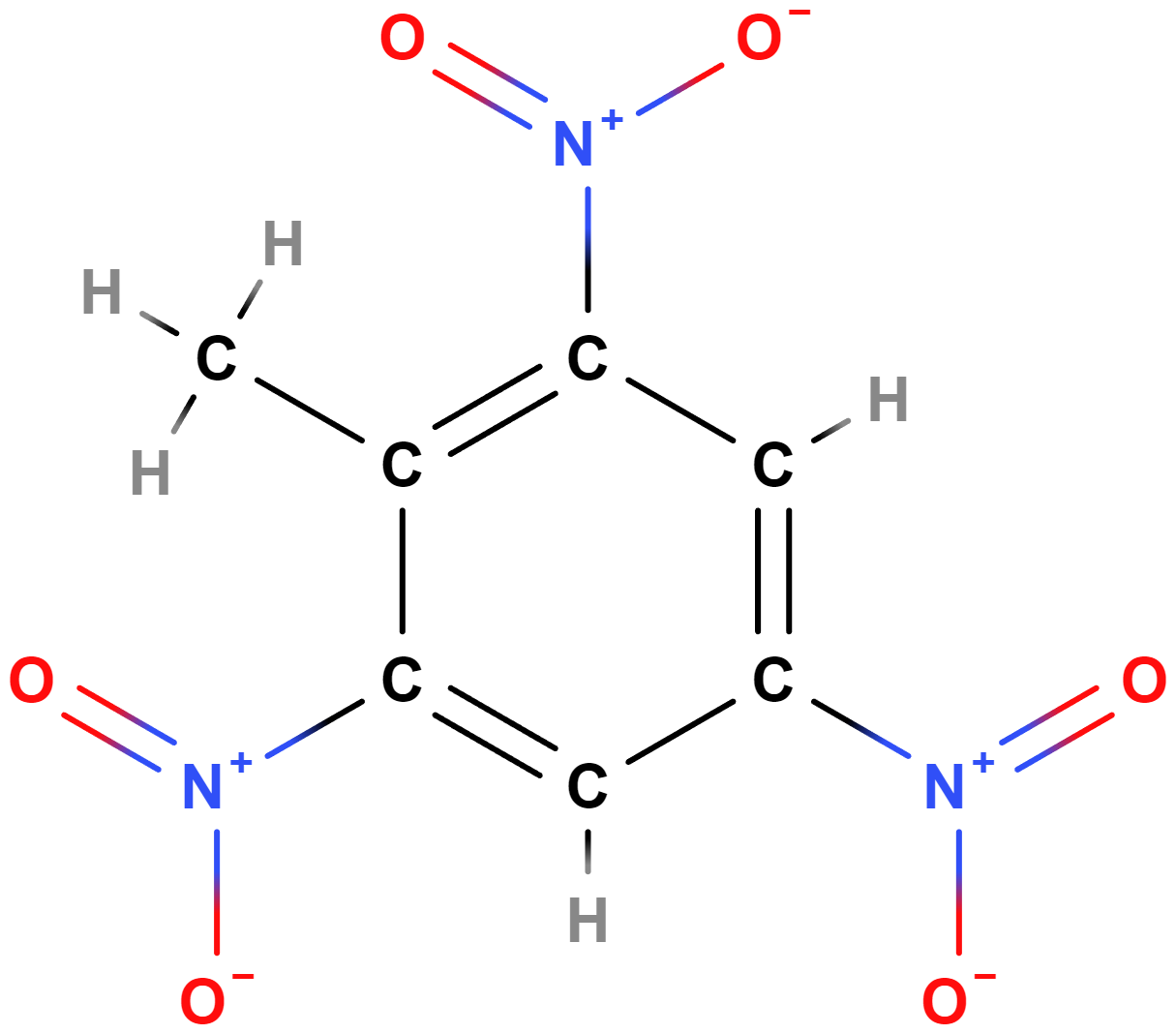
Nitroderiváty obsahují skupinu \mathrm{–NO_2}. Často se využívají k výrobě výbušnin, při jejich rozkladu vznikají obvykle \mathrm{N_2} a oxidy uhlíku v plynném skupenství. Mezi nitroderiváty patří např. TNT (trinitrotoluen) (vzorec níže) či složky trhaviny Semtex.
Alkoholy, fenoly, ethery
Alkoholy, fenoly i ethery patří mezi kyslíkaté deriváty uhlovodíků.
Alkoholy
Alkoholy jsou odvozené z alifatických uhlovodíků. Ve svých molekulách obsahují skupinu \mathrm{–OH}. Jejich název v základu obsahuje označení příslušného uhlovodíku s koncovkou -ol. Jde o látky běžné v přírodě, jsou dobře rozpustné ve vodě. Mezi alkoholy patří například:
- methanol
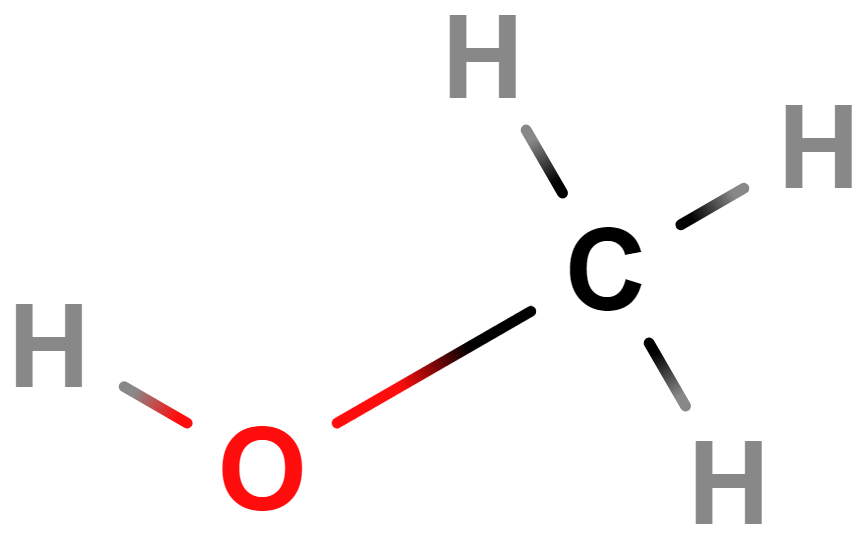
- Jedovatý, při požití hrozí oslepnutí/smrt.
- Používá se jako rozpouštědlo či k výrobě „bionafty“.
- V malém množství vzniká při kvašení, při destilaci alkoholických nápojů je nutné jej oddělit (má teplotu varu 65 °C, při zahřívání směsi se odděluje dříve než ethanol).
- V roce 2012 se v Česku odehrála methanolová aféra, kdy docházelo k ředění alkoholických nápojů methanolem. V bezprostředním časovém horizontu vedla k asi 50 úmrtím.
- ethanol (líh)
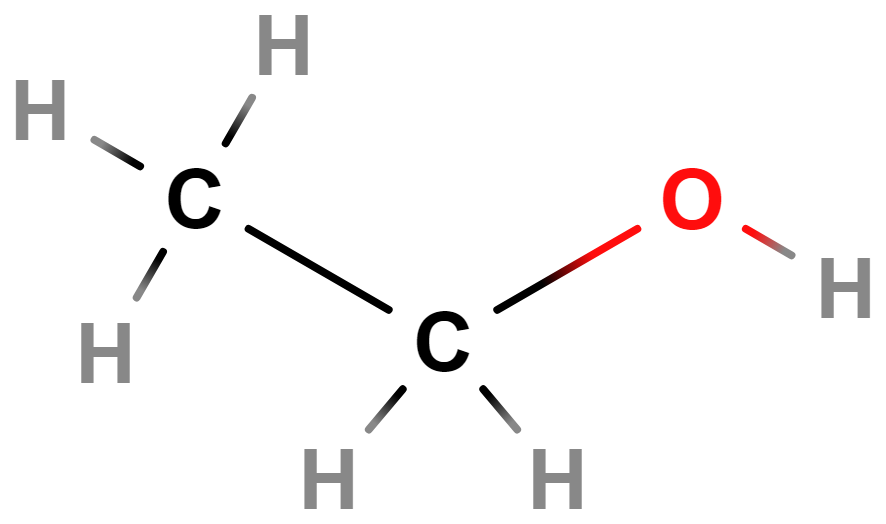
- Bezbarvá kapalina s teplotou varu 78 °C.
- Rozpouštědlo, palivo (např. do přenosných vařičů, lihových kahanů). Do lihu k technickému využití se přidávají látky, aby se nedal pít (denaturace).
- Součást alkoholických nápojů, vzniká kvašením cukrů za účasti kvasinek: \mathrm{C_6H_{12}O_6 \longrightarrow CH_3CH_2OH + CO_2}. Při požití vyřazuje z funkce určité části mozku (opilost). Pokud se mezi lidmi hovoří o „alkoholu“, myslí se tím obvykle právě ethanol.
- Játra ethanol odbourávají na toxický ethanal (acetaldehyd), který se spolu s dehydratací podílí na kocovině. Ethanal se posléze mění na kyselinu octovou, kterou lze metabolicky využít.
- Ethanol je dosud společensky tolerovanou drogou. To navzdory tomu, že jeho konzumace značně zvyšuje riziko rakoviny (nádorových onemocnění, jde o karcinogen 1. třídy) a chorob oběhového systému. Ničí játra, snadno vyvolává závislost.
- ethan-1,2-diol (ethylenglykol)
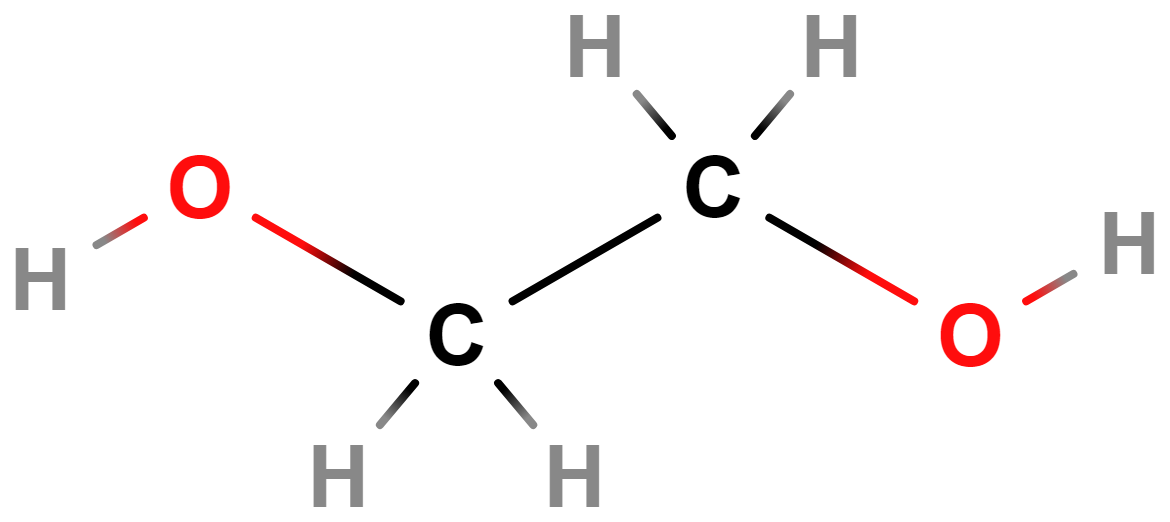
- Má teplotu tání −12,9 °C, používá se do nemrznoucích směsí či chladicích kapalin.
- propan-1,2,3-triol (glycerol)
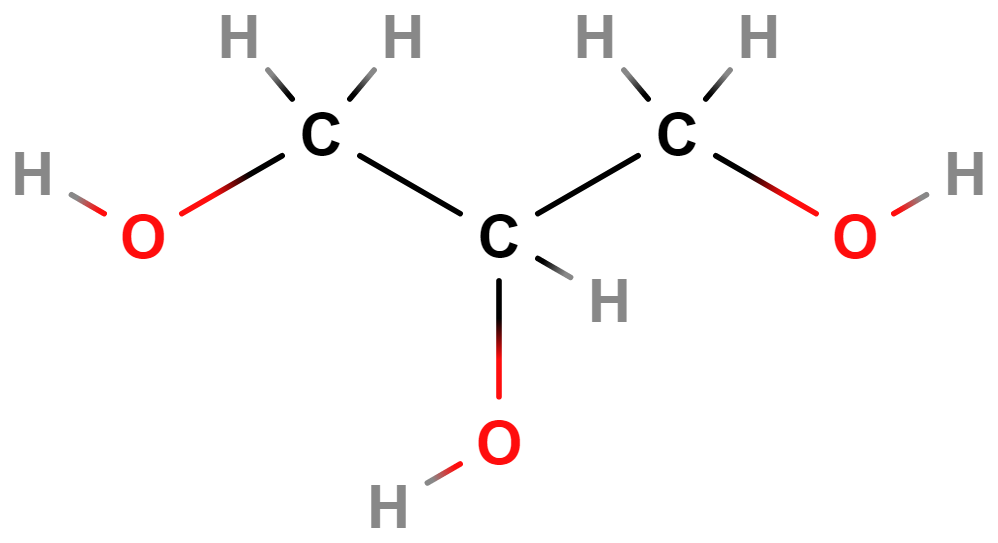
- Je součástí molekul tuků.
- Váže na sebe vodu, mnohdy se využívá v kosmetice.
Fenoly
Fenoly obdobně jako alkoholy obsahují skupinu \mathrm{–OH}, jsou však odvozené z aromatických uhlovodíků. Příkladem je fenol využívaný v chemickém průmyslu.
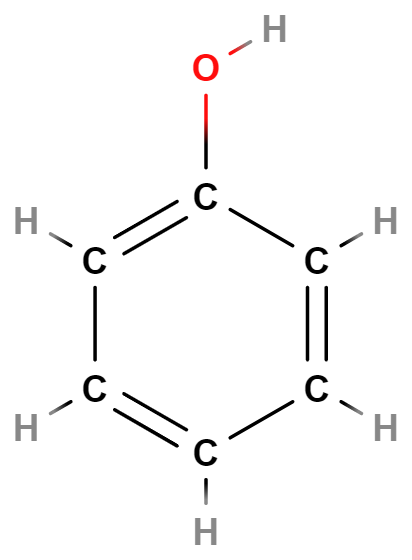
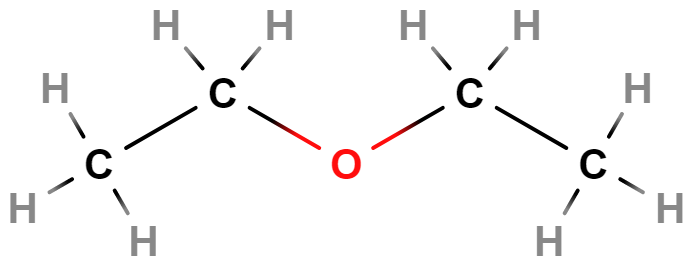
Ethery
Ve svých molekulách obsahují atom kyslíku navázaný na dva uhlovodíkové zbytky \mathrm{R–O–R'}. Příkladem je diethylether používaný jako rozpouštědlo, se vzduchem tvoří výbušné peroxidy.
Aldehydy, ketony
Aldehydy a ketony jsou kyslíkaté deriváty uhlovodíků. Patří mezi karbonylové sloučeniny. Obsahují karbonylovou skupinu \mathrm{C\!=\!O}. Jde o látky běžné v přírodě.
Aldehydy
Aldehydy obsahují karbonylovou skupinu na konci uhlíkového řetězce. Jejich názvy mají koncovku -al. Mezi aldehydy patří například:
- methanal (formaldehyd)
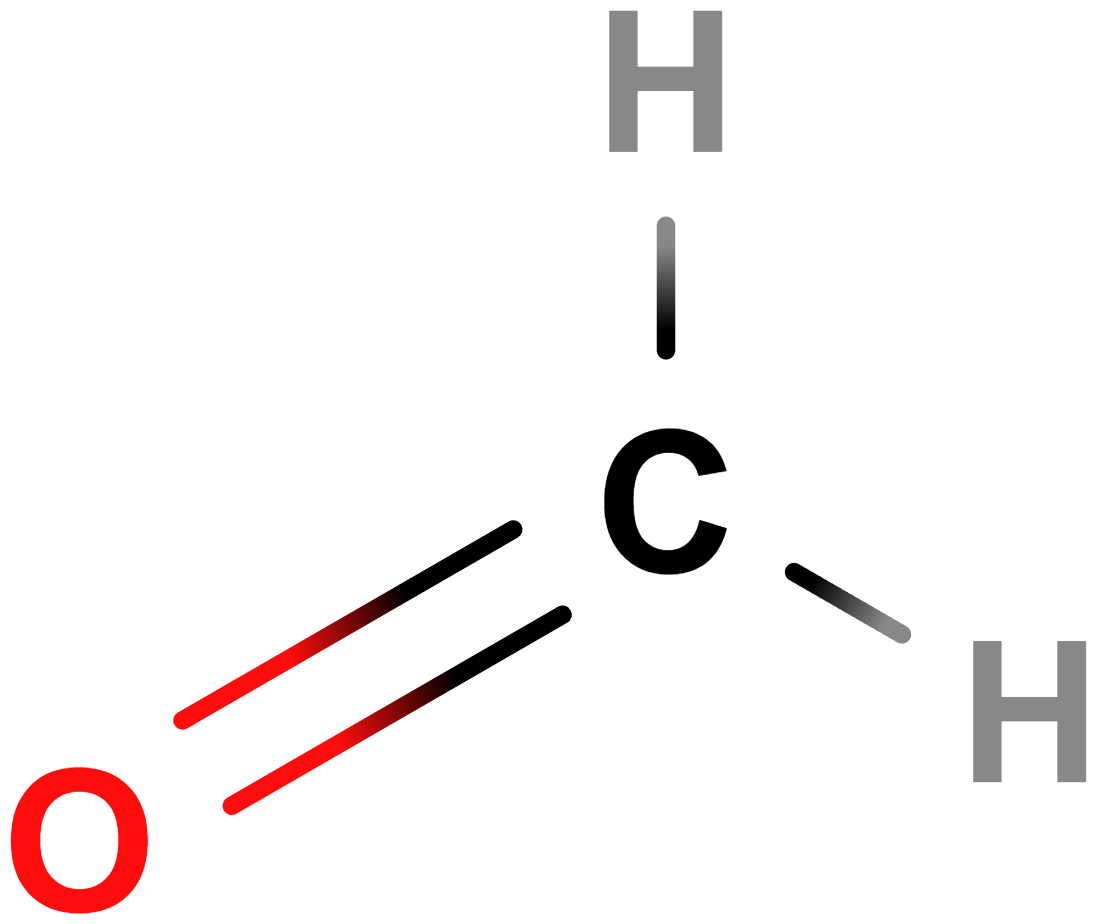
- Nejjednodušší aldehyd.
- Toxický, nebezpečný pro zdraví (karcinogenní), žíravý.
- Plyn ostrého zápachu, dobře rozpustný ve vodě. Jeho 40% roztok se označuje jako formalín, zředěný se používá ke konzervaci biologických materiálů.
- Významný pro chemický průmysl, vyrábějí se z něj různé polymery, mj. pryskyřice.
- ethanal (acetaldehyd)
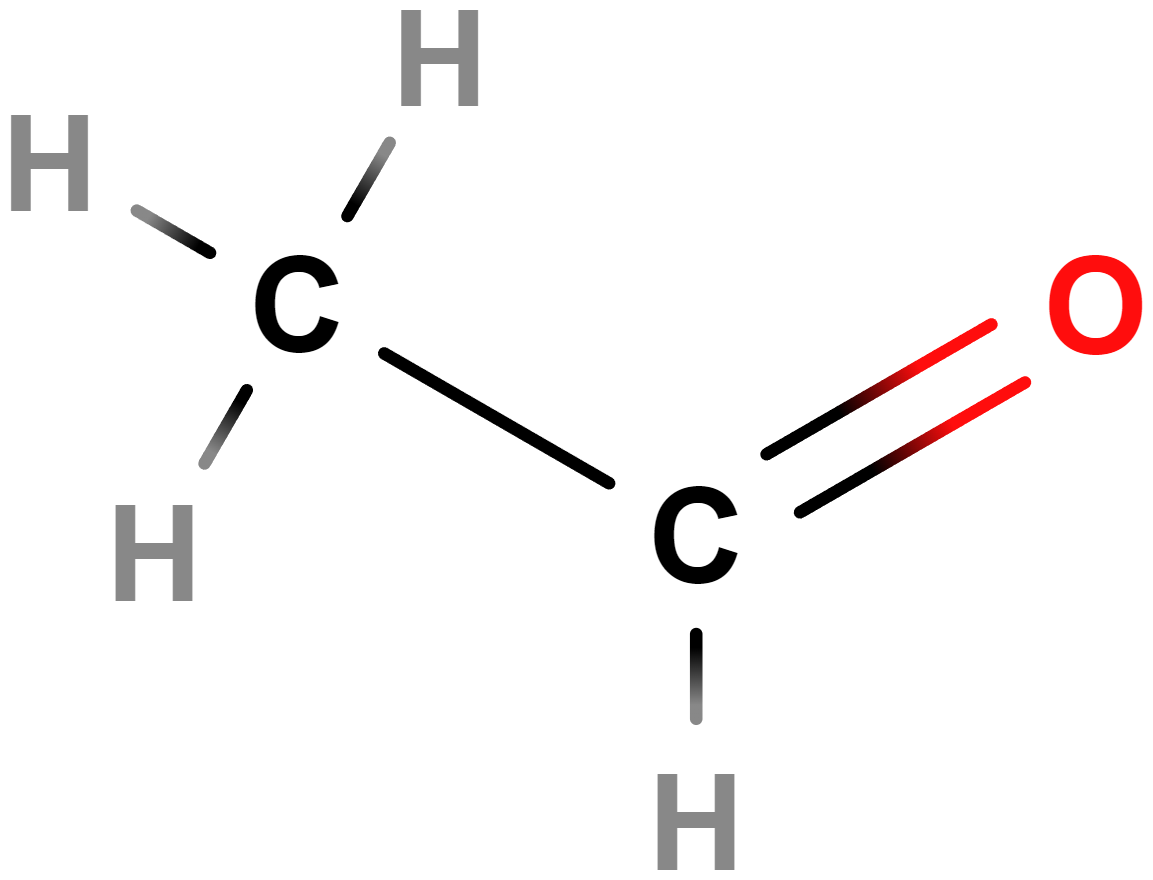
- Karcinogenní.
- Vzniká v těle při metabolických přeměnách ethanolu, podílí se na vzniku kocoviny a negativních důsledcích konzumace alkoholu.
Ketony
Ketony obsahují karbonylovou skupinu uvnitř uhlíkového řetězce. Jejich názvy mají koncovku -on.
- propan-2-on = dimethylketon (aceton)
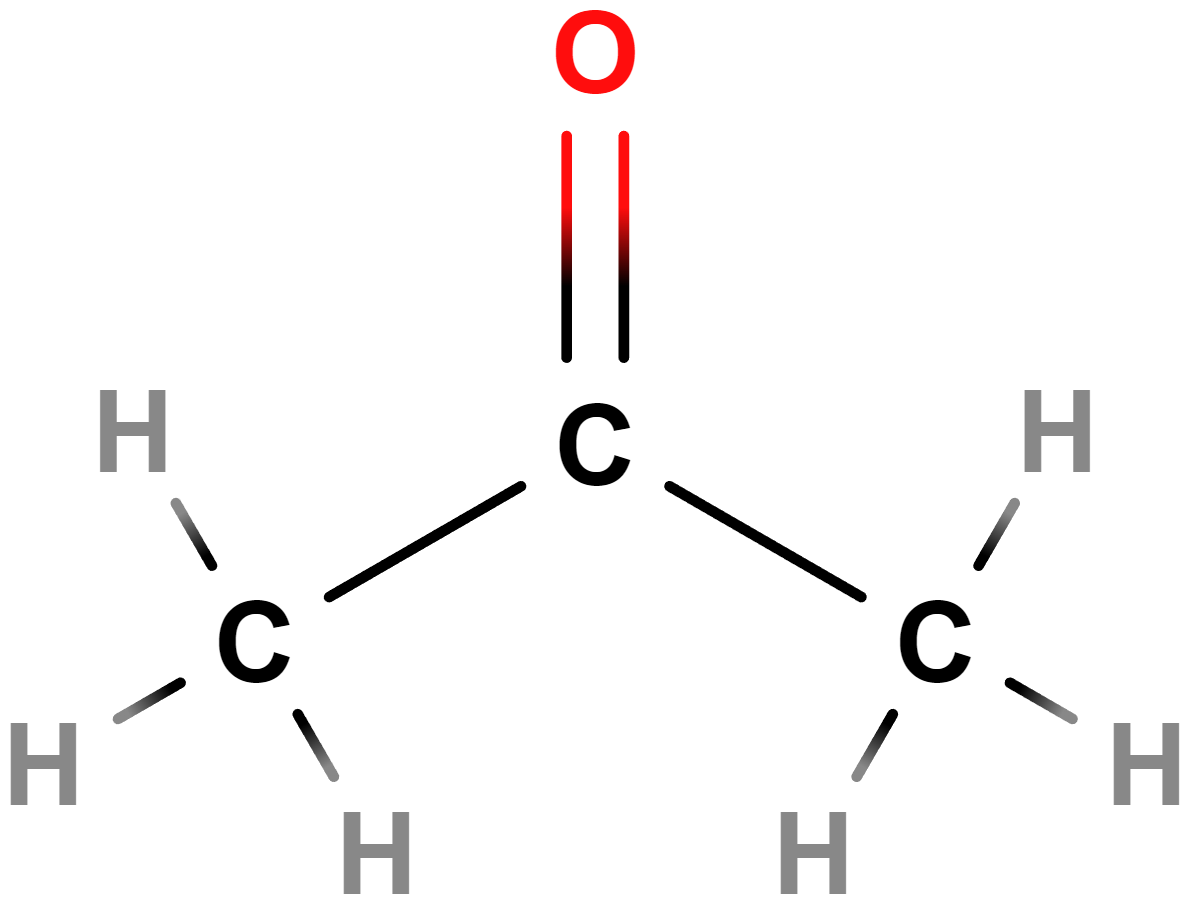
- Používá se jako rozpouštědlo.
- Hořlavý, dráždivý.
- Vzniká, když tělo přetváří tuky na cukry – jeho přítomnost v moči (či zápach v dechu) signalizuje diabetes.
Karboxylové kyseliny
Karboxylové kyseliny patří mezi kyslíkaté deriváty uhlovodíků. Jejich molekuly obsahují karboxylovou skupinu \mathrm{–COOH}. Z této funkční skupiny se snadno uvolňuje kation vodíku (\mathrm{H^+}), což podmiňuje kyselý charakter těchto látek. Karboxylové kyseliny se běžně nacházejí v živých organismech. Karboxylové kyseliny s krátkým uhlíkovým řetězcem mají obvykle štiplavý zápach.
Příklady karboxylových kyselin
- kyselina methanová (mravenčí)
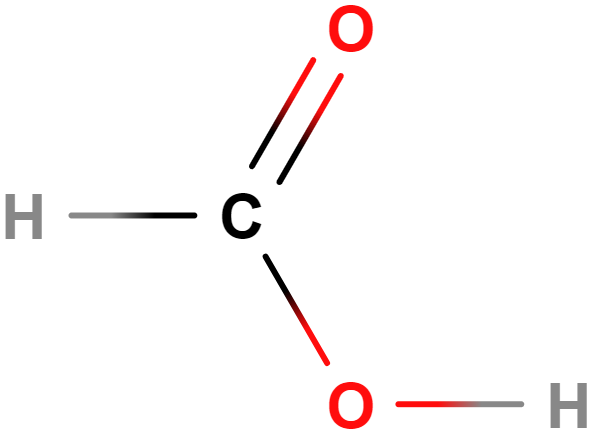
- Využívána mravenci k obraně, v žahavých chlupech kopřiv je jen v malém množství.
- Má uplatnění při hubení kleštíka včelího ve včelstvech, konzervuje rostlinnou hmotu při silážování.
- kyselina ethanová (octová)
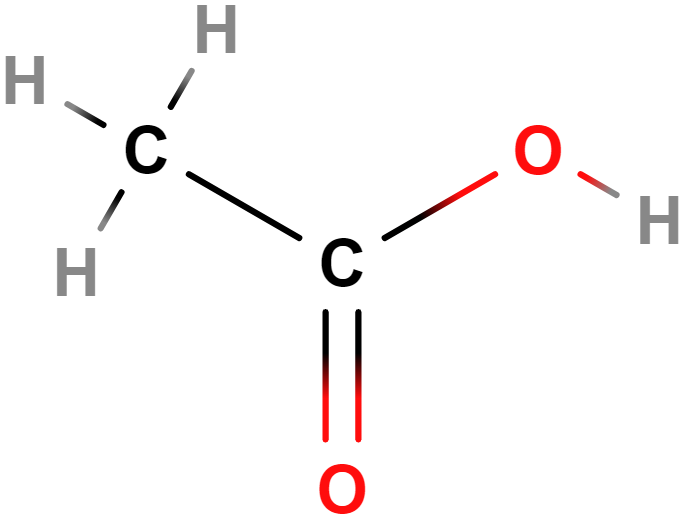
- Ocet je zpravidla 5–8% roztok. Pro potravinářské účely se vyrábí octovým kvašením ethanolu (ocet kvasný lihový, obvykle bývá uměle obarven), případně ovocných šťáv (např. jablečný ocet) či vína (balzamikový, vinný ocet).
- kyselina butanová (máselná)
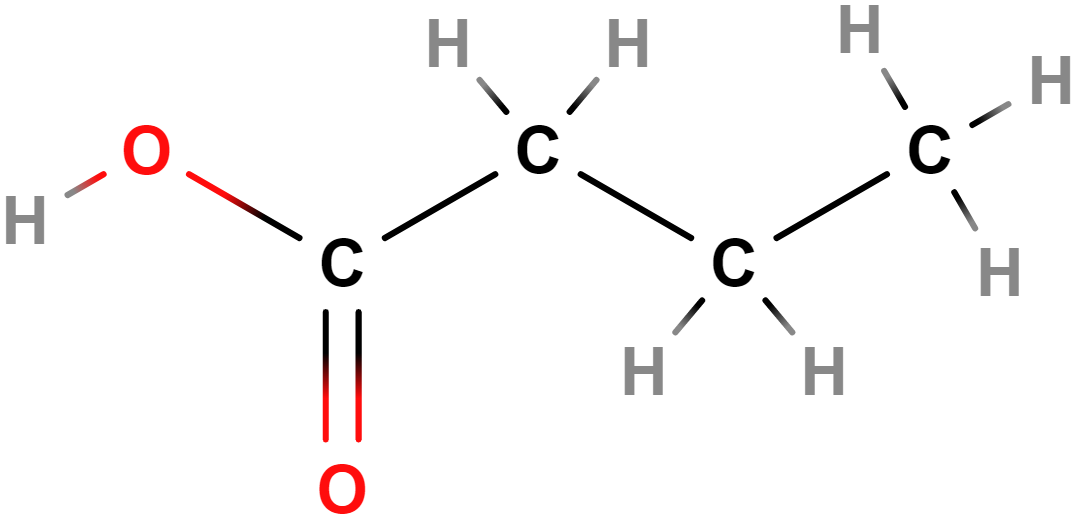
- Uvolňuje se při rozkladu tuků (např. metabolizaci tuků bakteriemi). Způsobuje např. aroma sýrů (parmezán, olomoucké tvarůžky, romadur aj.), ale také zvratků či potu.
- kyselina benzoová
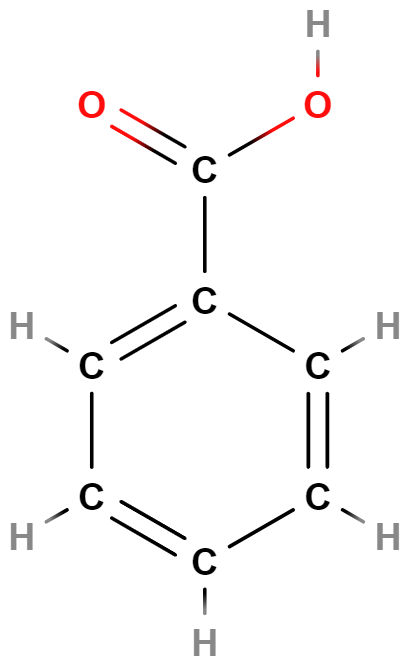
- Používá se jako konzervant.
- kyselina citronová
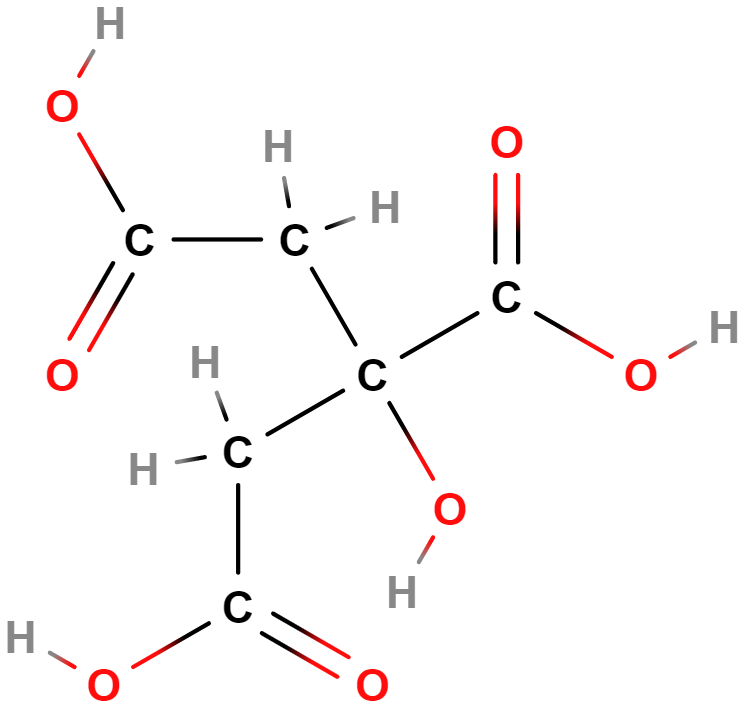
- Používá se jako konzervant či k okyselení potravin/nápojů.
- Je meziproduktem metabolismu v rámci buněčného dýchání (Krebsův cyklus = citrátový cyklus).
Mastné kyseliny tvoří součásti molekul tuků. Vyšší mastné kyseliny (např. kyselina palmitová, stearová, olejová) mají delší uhlíkové řetězce.
NahoruDeriváty karboxylových kyselin
Mezi funkční deriváty karboxylových kyselin patří např. jejich soli a estery. Funkční deriváty karboxylových kyselin vznikají vlivem zásahů do karboxylové skupiny.
Soli karboxylových kyselin
Soli karboxylových kyselin vznikají zejména jejich neutralizací. Dojde k odštěpení vodíkového kationtu (\mathrm{H^+}) z molekuly kyseliny a jeho nahrazení, nejčastěji iontem kovu. Mezi soli karboxylových kyselin patří například:
- octan sodný – Používá se proti otokům a naraženinám.
- benzoan sodný – Používá se jako konzervant.
- glutaman sodný – Jedná se o sůl aminokyseliny (kyseliny glutamové), způsobuje chuť umami.
- šťavelan vápenatý – Nerozpustná sůl, mnohdy přítomná v rostlinách (např. árónovitých). Tvoří drobné krystalky, které slouží rostlinám jako obrana před býložravci. Tato sůl je obsažena i v ledvinových kamenech.
Mýdla obsahují sodné nebo draselné soli vyšších mastných kyselin. Jejich molekuly jsou zčásti hydrofobní (odpuzují vodu, vážou se na ně nečistoty), zčásti hydrofilní (přitahují vodu, která je může i s navázanými nečistotami odplavit).
Estery karboxylových kyselin
Estery karboxylových kyselin jsou v přírodě významnými vonnými látkami (jsou např. součástí plodů, květů). Vznikají reakcí karboxylové kyseliny a alkoholu (esterifikací), produktem reakce je ester a voda. Používají se např. jako aromata do potravin, rozpouštědla či k výrobě plastů.
Ethylester kyseliny octové (ethyl-ethanoát) má využití v odlakovačích na nehty a jako rozpouštědlo. Methylestery mastných kyselin (MEŘO = methylester řepkového oleje) jsou součástí biosložky nafty. Tuky jsou přirozeně se vyskytující estery mastných kyselin a propan-1,2,3-triolu (glycerolu).
Substituční deriváty karboxylových kyselin
Substituční deriváty karboxylových kyselin mají navázané další funkční skupiny na uhlíkovém řetězci. Patří mezi ně např. hydroxyderiváty karboxylových kyselin (atomy \mathrm{H} jsou nahrazeny skupinou \mathrm{–OH}), halogenkarboxylové kyseliny (atomy \mathrm{H} jsou nahrazeny atomy halogenů) či aminokyseliny (atomy \mathrm{H} jsou nahrazeny skupinou \mathrm{–NH_2}).







