Chemické vlastnosti určitého prvku jsou ovlivněny zejména stavbou elektronového obalu jeho atomů.
Elektrony, orbitaly
Elektrony mají dle kvantově mechanického modelu charakter vlny i částice (to se označuje jako dualismus). Nelze např. současně určit jejich polohu a hybnost, lze určit jen pravděpodobnost, s níž se budou vyskytovat v určitém prostoru. Oblast s určitou pravděpodobností výskytu elektronu (obvykle >95 %) se nazývá orbital.
Kvantová čísla
Stav elektronu lze popsat pomocí kvantových čísel:
- Hlavní kvantové číslo (n) je přirozené číslo. Souvisí s energií elektronů a velikostí orbitalů (čím větší n, tím se elektrony mohou nacházet dále od jádra).
- Vedlejší kvantové číslo (l) udává typ orbitalu, spočítá se dle vztahu l = n - 1. Podle vedlejšího kvantového čísla se orbitaly označují písmeny: 0 = s, 1 = p, 2 = d, 3 = f.
Tvary orbitalů, souvislosti

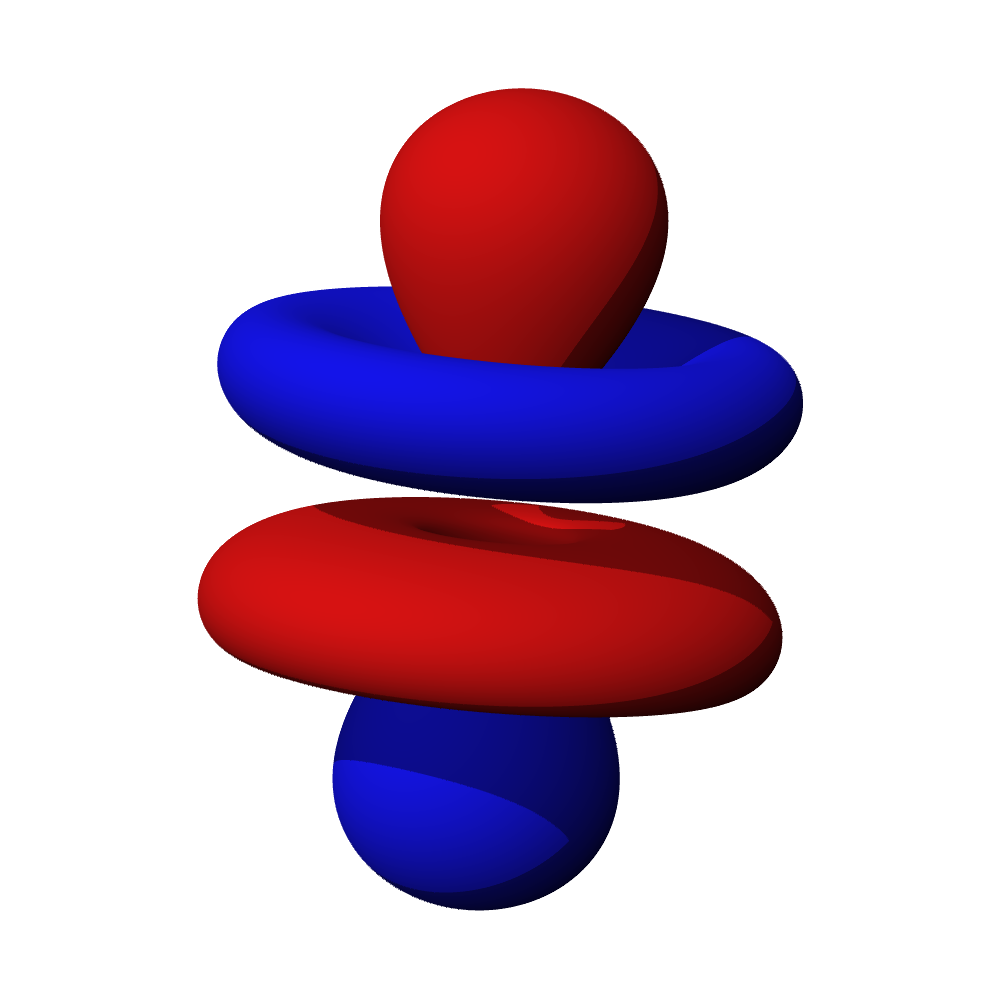
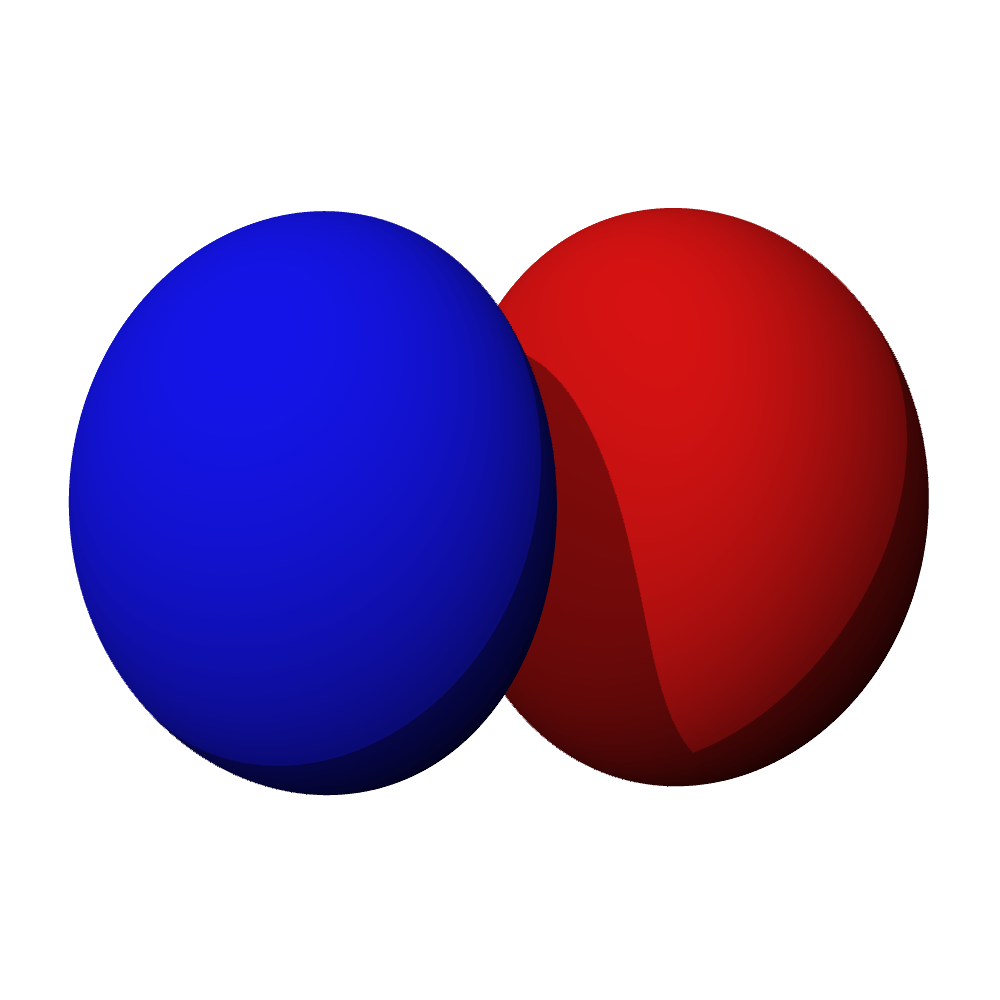
a – příklad orbitalu s
b – příklad orbitalu p
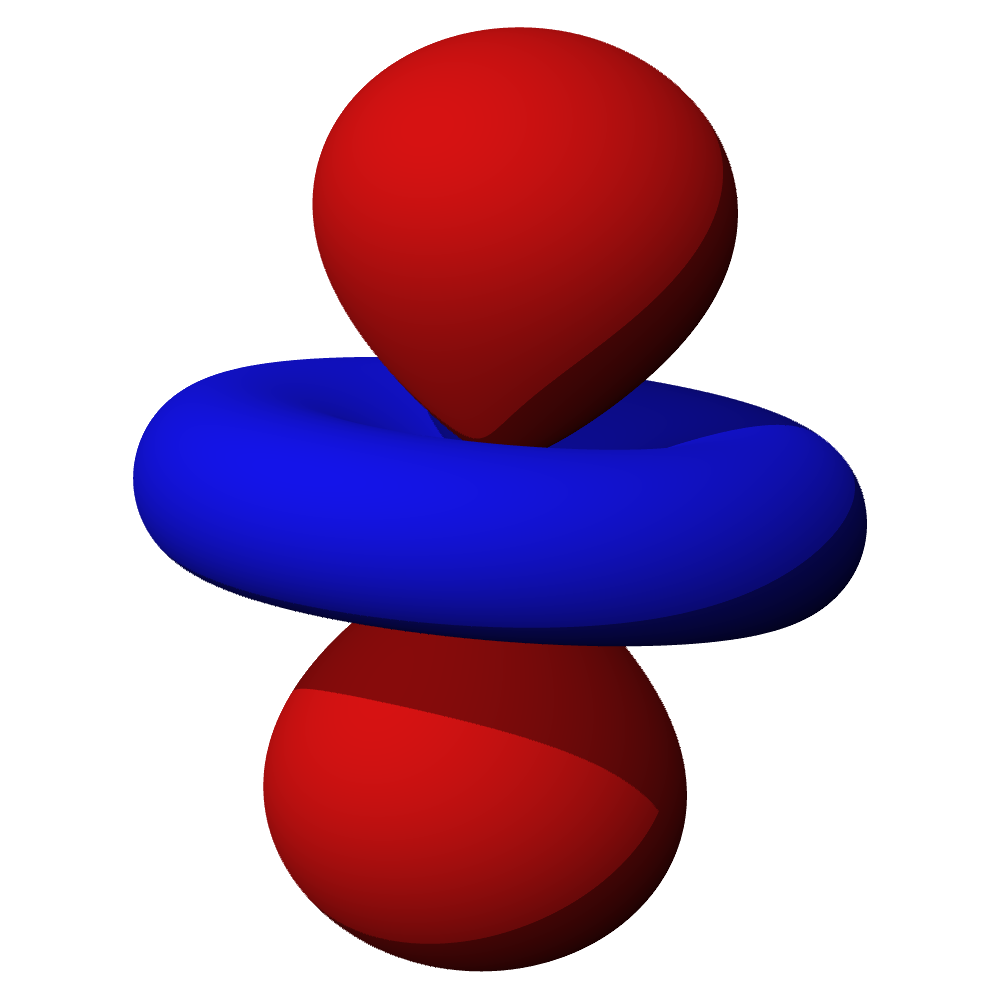
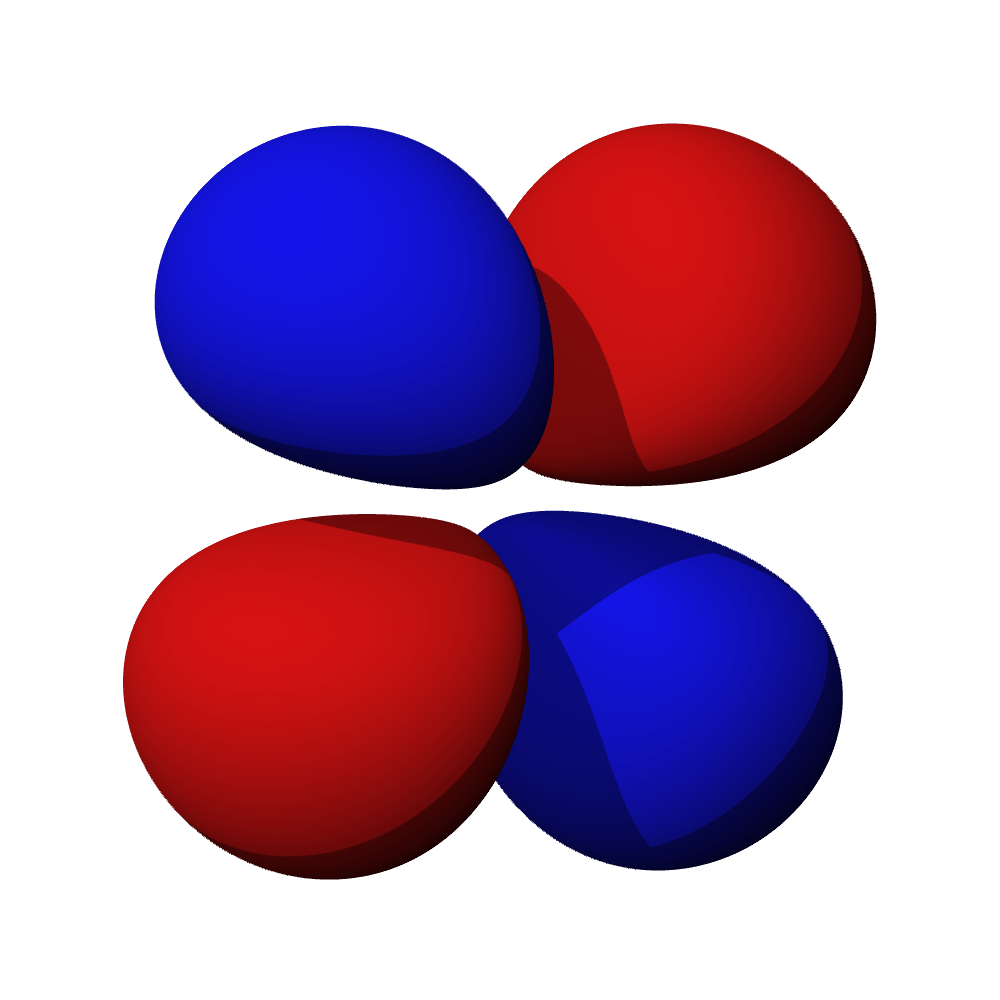
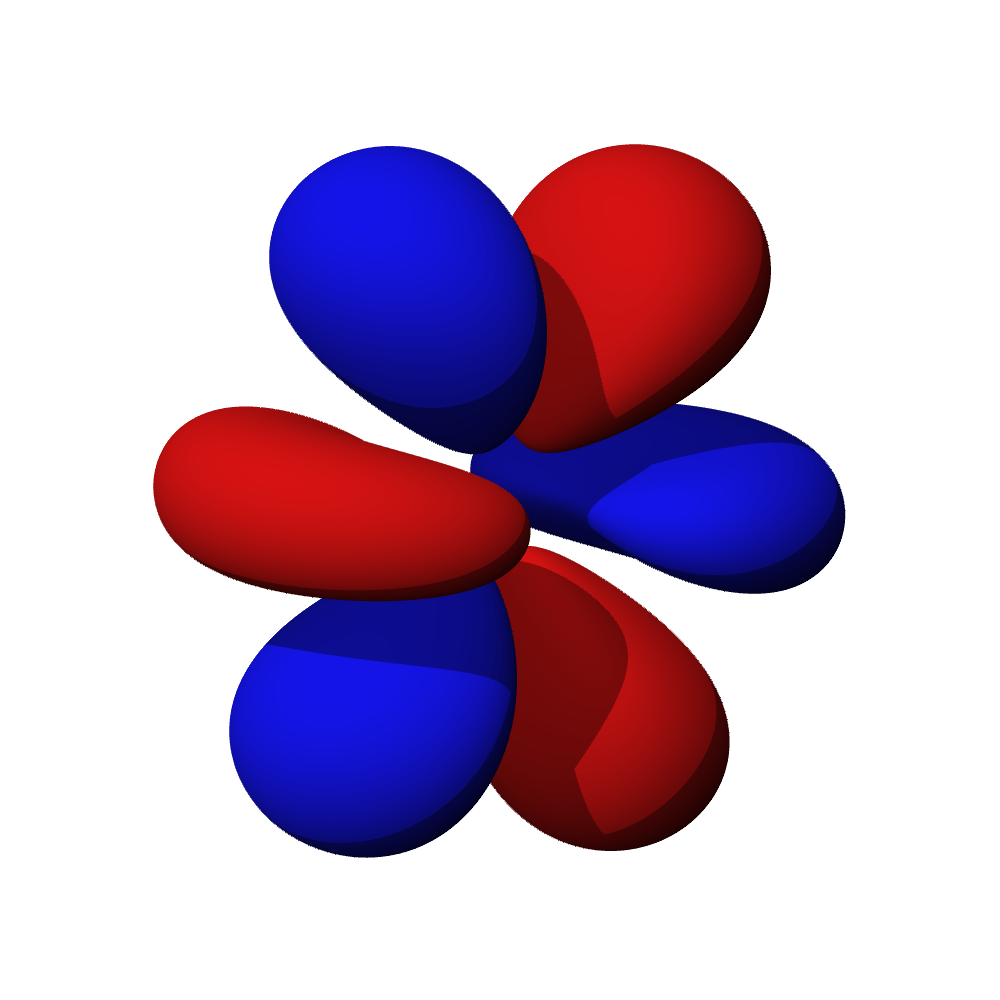
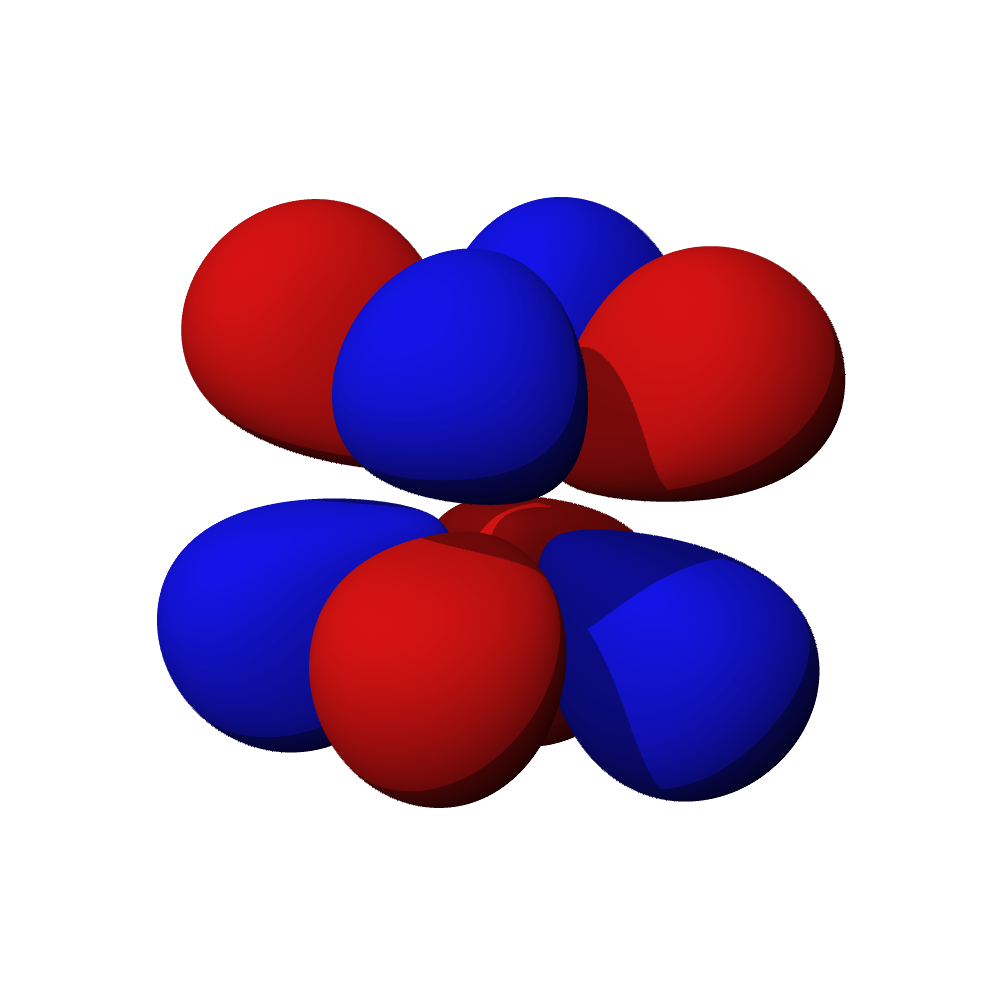
c – příklady orbitalů d
- Orbitaly s mají tvar koule. Orbitaly p se podobají dvěma lalokům. Tvary orbitalů d a f jsou komplexnější.
- Orbital d obsazují přechodné kovy, orbital f vnitřně přechodné kovy (lanthanoidy, aktinoidy). Prvky obsazující orbital g zatím nebyly objeveny.
- Magnetické kvantové číslo (m) udává prostorovou orientaci orbitalu, nabývá celočíselných hodnot od -l do l (včetně 0). Počet magnetických kvantových čísel pro určité vedlejší kvantové číslo souvisí s počtem případných degenerovaných orbitalů (orbitaly, které mají při stejné energii různou prostorovou orientaci).
Příklad: magnetické kvantové číslo
Pokud je vedlejší kvantové číslo l = 1 (typ orbitalu p) jsou magnetická kvantová čísla m = -1; 0; 1: \boxed{\phantom{\uparrow \downarrow} }\,\boxed{\phantom{\uparrow \downarrow} }\,\boxed{\phantom{\uparrow \downarrow} }. Typ orbitalu p se tedy rozděluje na tři degenerované orbitaly s různou prostorovou orientací.
- Spinové kvantové číslo (s) charakterizuje spin elektronu, nabývá hodnoty \frac{1}{2} či - \frac{1}{2}. V grafickém znázornění šipka značí elektron, spin se vyjadřuje směrem šipky (např. \boxed{\uparrow \downarrow }).
Valenční elektrony
Za chemické vlastnosti atomů zodpovídají zejména valenční elektrony, ty se nacházejí v orbitalech s nejvyšším hlavním kvantovým číslem (u přechodných kovů i s druhým nejvyšším). Mohou tedy být nejdále od jádra a mají nejvyšší energii.
Částice nepřechodných prvků jsou obvykle stabilní, když jejich valenční vrstva odpovídá valenční vrstvě vzácného plynu (neboli obsahuje nejčastěji 8 elektronů = oktet). To je důvodem, proč některé prvky ochotně tvoří ionty (např. \mathrm{O^{2-}}, \mathrm{F^{-}}, \mathrm{Na^{+}}, \mathrm{Mg^{2+}} mají 8 valenčních elektronů jako neon).
Elektronová konfigurace
Elektronová konfigurace popisuje uspořádání elektronů v orbitalech. U zkráceného textového zápisu se zahrnuje předchozí vzácný plyn, explicitně jsou tedy vypsány jen valenční elektrony:
| lithium (\mathrm{Li}) |
\mathrm{1s}\,\boxed{\uparrow\downarrow}\;\mathrm{2s}\,\boxed{\uparrow\ } |
\mathrm{1s^2}\,\mathrm{2s^1} |
\mathrm{[He]}\,\mathrm{2s^1} |
| hořčík (\mathrm{Mg}) |
\mathrm{1s}\,\boxed{\uparrow\downarrow}\;\mathrm{2s}\,\boxed{\uparrow\downarrow}\;\mathrm{2p}\,\boxed{\uparrow \downarrow}\,\boxed{\uparrow \downarrow}\,\boxed{\uparrow \downarrow}\;\mathrm{3s}\,\boxed{\uparrow \downarrow } |
\mathrm{1s^2}\,\mathrm{2s^2}\,\mathrm{2p^6}\,\mathrm{3s^2} |
\mathrm{[Ne]}\,\mathrm{3s^2} |
V rámci elektronové konfigurace platí:
- Pauliho princip výlučnosti – V atomu není více elektronů, které by měly všechna kvantová čísla stejná. V jednom orbitalu mohou být nanejvýš dva elektrony lišící se spinovým číslem (např. \boxed{\uparrow \downarrow }).
- Hundovo pravidlo – Degenerované orbitaly (orbitaly se stejnou energií) se nejprve zaplňují vždy nejprve jedním elektronem, pak až dvěma. Příklad na orbitalu p se 3 elektrony: \boxed{\uparrow\ }\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }, se 4 elektrony: \boxed{\uparrow\downarrow}\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }.
- výstavbový princip – Orbitaly s nižší energií se zaplňují dříve než orbitaly s vyšší energií (1s, 2s, 2p, 3s, 3p, 4s…).
Excitovaný stav
Při excitaci atomu elektron či elektrony přijmou energii a dostávají se do orbitalu s vyšší energií (poruší výstavbový princip). Níže je příklad elektronové konfigurace atomu \mathrm{C} a excitovaného atomu \mathrm{C}. \mathrm{C\!: 1s\,\boxed{\uparrow\downarrow}\;2s\,\boxed{\uparrow\downarrow}\;2p\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }\,\boxed{\phantom{\uparrow}\ }}
\mathrm{C^*\!: 1s\,\boxed{\uparrow\downarrow}\;2s\,\boxed{\uparrow\ }\;2p\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }}