
Chemická vazba, molekuly

Částice mohou být stabilnější, pokud se sloučí s jinými částicemi, neboli mezi sebou vytvoří chemickou vazbu. Vazeb se účastní valenční elektrony, nové vazby se tvoří při chemických reakcích. Díky chemickým vazbám mohou vznikat molekuly (částice z více atomů/iontů), ale také sloučeniny (ty obsahují více různých prvků).
V rámci jednoduché kovalentní vazby jsou atomy spojené díky elektronovému páru. Do strukturních vzorců se vazba mezi částicemi vyznačuje jako linie spojující značky prvků.
Příklad: molekula amoniaku
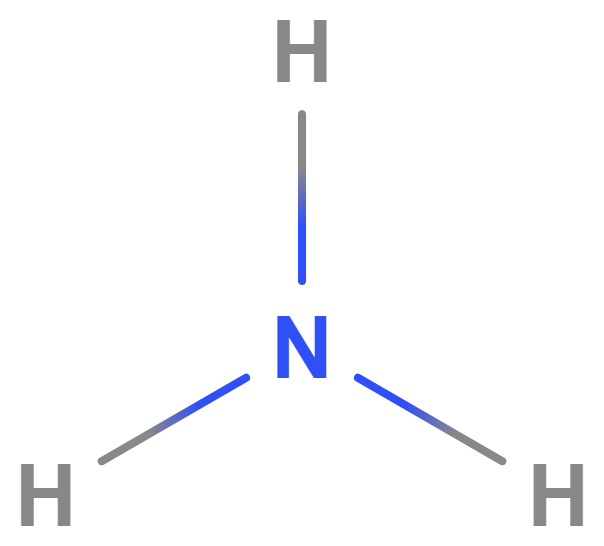
Na obrázku je strukturní vzorec molekuly amoniaku (\mathrm{NH_3}). Ta se skládá z jednoho atomu dusíku (\mathrm{N}) a tří atomů vodíku (\mathrm{H}). Mezi atomem \mathrm{N} a každým atomem \mathrm{H} se nachází jednoduchá kovalentní vazba, která je vyznačena jako linie. Každá jedna jednoduchá vazba v molekule je tvořena dvěma valenčními elektrony.
Vazby mezi atomy mohou být i násobné. Na dvojné vazbě se podílí 2 elektronové páry (4 elektrony), na trojné se podílí 3 elektronové páry (6 elektronů). Díky kovalentní vazbě atomy mnohdy dosahují elektronové konfigurace nejbližšího vzácného plynu.
Elektronegativita je schopnost atomu přitahovat (vazebné) elektrony. Její hodnotu lze najít v periodické tabulce. Dle polarity – rozdílu elektronegativit (\Delta\chi) zúčastněných atomů – se rozlišuje:
- nepolární vazba – Vazebné elektrony jsou rozloženy téměř rovnoměrně (\Delta\chi \lt 0{,}4).
- polární vazba – Vazebné elektrony jsou posunuty k atomu s vyšší elektronegativitou (\Delta\chi = 0{,}4{-}1{,}7).
- iontová vazba – Tvoří se ionty (\Delta\chi \gt 1{,}7).
Hranice mezi výše uvedenými typy vazeb jsou neostré. Obvykle platí, že polární (iontové) látky se rozpouštějí v polárních rozpouštědlech, nepolární v nepolárních.
Zavřít










