Dusík, síra a fosfor jsou nekovové prvky, které jsou významné jak pro průmysl, tak pro živé organismy.
Dusík
Dusík (\mathrm{N}) je za standardních podmínek plyn. Zaujímá 78 % objemu suchého vzduchu.
Je tvořen dvouatomovými molekulami \mathrm{N_2}. Mezi jednotlivými atomy \mathrm{N} je v této molekule stabilní trojná vazba, proto je plynný dusík poměrně nereaktivní. Z tohoto důvodu se používá jako inertní atmosféra při konzervaci potravin (např. balených sýrů).
Dusík má teplotu varu −196 °C. Kapalný dusík se v medicíně využívá např. pro odstraňování bradavic či pro chlazení biologického materiálu (třeba uchovávání pohlavních buněk).
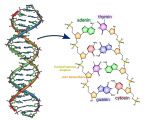
Dusík je zásadní součástí biomolekul, jde o prvek nezbytný pro život. Je součástí aminokyselin, z nichž jsou tvořeny bílkoviny (proteiny). Dusík je obsažen i v nukleových kyselinách (DNA, RNA).
Atmosférický dusík je v přírodě zabudováván do organických sloučenin díky činnosti bakterií (včetně sinic). Ze sloučenin jej do ovzduší naopak uvolňují zejména denitrifikační bakterie.
Dusík je nepostradatelný pro růst rostlin, proto bývá součástí hnojiv. Předstupněm pro výrobu hnojiv je Haberův–Boschův proces, který průmyslově zabudovává atmosférický dusík do molekul amoniaku (\mathrm{NH_3}).
Haberův–Boschův proces
Haberův–Boschův proces je zásadní pro výrobu hnojiv. Jeho zavádění počátkem 20. století vedlo ke zvyšování zemědělských výnosů a tím pádem i k zásadnímu růstu lidské populace. Odhaduje se, že asi 40–50 % atomů \mathrm{N} v lidském těle bylo tímto procesem fixováno z ovzduší.
Mezi další sloučeniny dusíku patří třeba jeho oxidy (souhrnně se označují jako \mathrm{NO}_x), které jsou škodlivou součástí emisí, např. při spalování fosilních paliv.
Síra
Síra (\mathrm{S}) je za standardních podmínek pevná látka žluté barvy. Má typický „pekelný“ zápach.

a – síra
V přírodě se nachází čistá zejména v okolí sopek (ve vulkanicky aktivních oblastech). Je součástí mnohých minerálů (např. pyritu – \mathrm{FeS_2}). V živých organismech jsou atomy síry obsaženy třeba v některých aminokyselinách.
Síra jakožto samostatný prvek se využívá např. při vulkanizaci kaučuku (zlepšuje/upravuje vlastnosti „gumy“, např. při výrobě pneumatik).
Sloučeniny síry
Mezi anorganické sloučeniny síry patří například:
- kyselina sírová (\mathrm{H_2SO_4}) – Zásadní pro chemický průmysl (výroba hnojiv, barviv, léků…).
- oxid siřičitý (\mathrm{SO_2}) – Konzervant v potravinářství. Při přítomnosti v ovzduší může způsobovat kyselé deště.
- síran vápenatý (\mathrm{CaSO_4}) – Součást minerálu sádrovce. Ve stavebnictví využíván jako sádra.
Fosfor
Fosfor (\mathrm{P}) jakožto prvek existuje v několika základních formách:
- bílý fosfor (b) – Vysoce reaktivní, toxický. Tvořen molekulami \mathrm{P_4}.
- červený fosfor – Stabilnější, používá se např. v rámci zápalek (c, hlavičky zápalek i zápalné plochy na krabičkách).
- černý fosfor – Stabilní, svou strukturou připomíná diamant.

b – bílý fosfor

c – zápalky

d – apatit
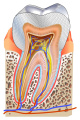
V přírodě se fosfor obvykle vyskytuje ve formě fosforečnanových aniontů (\mathrm{PO_4^{3-}}). Tyto ionty obsahuje třeba minerál apatit (d). Hydroxyapatit je součástí kostí či zubů živočichů.
Co se týká organických sloučenin, atomy fosforu jsou obsaženy např. v nukleových kyselinách (DNA, RNA), ATP (nosič energie v buňkách) či fosfolipidech, které tvoří buněčné membrány.
Eutrofizace vod
Nadměrný přísun dusíku (ve formě dusičnanů – \mathrm{NO_3^-}) a/nebo fosforu (ve formě fosforečnanů – \mathrm{PO_4^{3-}}) vede k tzv. eutrofizaci vod. Tyto vody pak obsahují nadměrné množství živin. To obvykle vede k přemnožení řas a sinic a následnému narušení rovnováhy ekosystému.
Cykly \mathrm{N}, \mathrm{S} a \mathrm{P}
V tématu na předmětu biologie je možné procvičit základní informace o cyklech těchto prvků v přírodě.