Soli jsou sloučeniny iontového charakteru. Obvykle se jedná o pevné látky s krystalickou strukturou, které v tavenině vedou elektrický proud. Zpravidla jsou rozpustné ve vodě (v polárních rozpouštědlech). Vznikají například neutralizací, tedy reakcí kyseliny a hydroxidu.
Bezkyslíkaté soli
Bezkyslíkaté soli odpovídají halogenidům či sulfidům.
Soli kyslíkatých kyselin
Název solí kyslíkatých kyselin se skládá z podstatného jména (to se týká aniontu pocházejícího z kyslíkaté kyseliny) a přídavného jména (týká se kationtu, obvykle iontu kovu). Například = dusičnan draselný.
| Oxidační číslo kyselinotvorného prvku | Příklad podstatného jména/aniontu |
|---|---|
| I | chlornan \mathrm{(ClO)^{-I}} |
| III | dusitan \mathrm{(NO_2)^{-I}} |
| IV | uhličitan \mathrm{(CO_3)^{-II}}, siřičitan \mathrm{(SO_3)^{-II}}, křemičitan \mathrm{(SiO_3)^{-II}} |
| V | dusičnan \mathrm{(NO_3)^{-I}}, trihydrogenfosforečnan = fosforečnan \mathrm{(PO_4)^{-III}}, chlorečnan \mathrm{(ClO_3)^{-I}} |
| VI | síran \mathrm{(SO_4)^{-II}} |
| VII | manganistan \mathrm{(MnO_4)^{-I}} |
Převádění názvu na vzorec
Příklad: dusičnan manganatý
- Nejprve vytvoříme část vzorce odpovídající aniontu (je nutné ovládat tvoření vzorců kyslíkatých kyselin, nebo si základní kyseliny pamatovat – vizte výše). Dusičnan → bude se jednat o kyselinu dusičnou \mathrm{HNO_3}.
- Anion kyseliny vzniká tak, že kyselina odštěpí kationt(y) vodíku. Bude mít tedy podobu \mathrm{(NO_3)^{-I}}.
- Přidáme prvek tvořící kation s patřičným oxidačním číslem, v tomto případě \mathrm{Mn} s oxidačním číslem II (-natý). \mathrm{Mn^{II}(NO_3)^{-I}}.
- Součet oxidačních čísel – respektive (myšlených) nábojů – v elektricky neutrální molekule je 0. S ohledem na to upravíme počet iontů. Lze použít i křížové pravidlo a oxidační číslo jednoho iontu „převést“ na počet výskytů druhého iontu: \mathrm{Mn^{II}(NO_3)^{-I}_{2}} → \mathrm{Mn(NO_3)_{2}}
Převádění vzorce na název
Příklad: \mathrm{Al_2(SO_4)_3}
- Při převádění vzorce na název je nutné si pamatovat/vyhledat buď podobu aniontů kyselin, nebo typická oxidační čísla částic prvků. Ideální je použít kombinaci obojího.
- Vycházíme-li ze znalosti aniontu:
- Víme, že sůl obsahuje síranový anion, který je odvozený z kyseliny sírové (\mathrm{H_2SO_4}). Tento anion má oxidační číslo −II (vznikne odštěpením dvou iontů \mathrm{H^+}).
- Celkový součet oxidačních čísel síranových aniontů je −6.
- Aby byl součet oxidačních čísel v molekule 0, každá jedna z částic hliníku musí mít oxidační číslo III.
- Vycházíme-li z typických oxidačních čísel (u iontů odpovídají jejich nábojům):
- Hliník (Al) má typické oxidační číslo III. Přídavné jméno bude hlinitý.
- Kyslík (O) se ve sloučeninách typicky vyskytuje v oxidačním čísle −II (pokud není sloučen s fluorem).
- Síra (S) musí tedy mít oxidační číslo VI → podstatné jméno bude síran.
- Sůl vzorce \mathrm{Al_2(SO_4)_3} je síran hlinitý.
Příklady solí kyslíkatých kyselin
- uhličitan vápenatý (\mathrm{CaCO_3}) – Součástí minerálu kalcitu či hornin vápence/mramoru. Tvoří oporné struktury a schránky živočichů a dalších organismů. Součástí vodního kamene.
- uhličitan sodný (\mathrm{Na_2CO_3}) – Soda na praní, změkčovadlo vody. Používá se také např. při výrobě skla či papíru.
- hydrogenuhličitan sodný (\mathrm{NaHCO_3}) – Jedlá soda, např. součástí kypřicích prášků.
- chlornan sodný (\mathrm{NaClO}) – K dezinfekci, bělicí činidlo (např. v Savu či k úpravě vody v bazénech).
- dusitan draselný (\mathrm{KNO_2}) – Používá se jako konzervant v uzeninách.
- pentahydrát síranu měďnatého (\mathrm{CuSO_4 \cdot 5\,H_2O}) – Modrá skalice, sůl typické modré barvy.
- dusičnany (\mathrm{NO_3^-}), fosforečnany (\mathrm{PO_4^{3-}}) – Bývají součástí hnojiv. Jejich uvolňování do životního prostředí vede k eutrofizaci vod, v nichž se pak mohou přemnožit sinice nebo řasy.
Organické soli
Tato kapitola se zabývá hlavně solemi anorganických kyselin. Soli ale mohou mít i organickou podstatu (vizte kapitolu deriváty karboxylových kyselin).
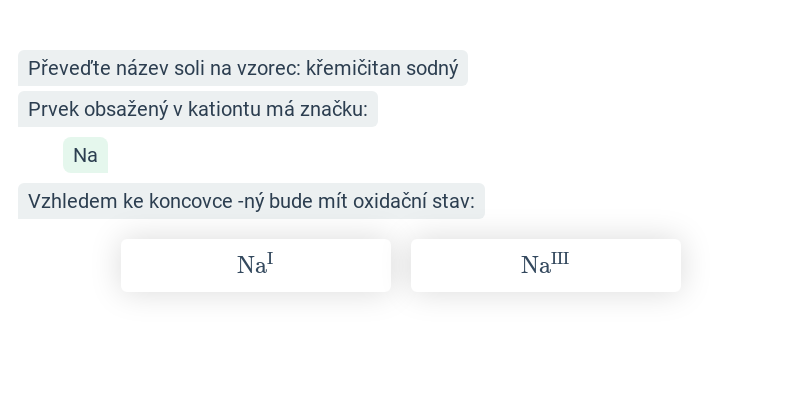
Krok po kroku
Doplňování jednotlivých kroků v rozsáhlejším postupu.
Poznávačka
Procvičování pojmů nebo názvů. Obsahuje dynamickou nápovědu.