Ionty jsou elektricky nabité částice, které vznikají z atomů (či molekul) přijetím či odevzdáním elektronů.
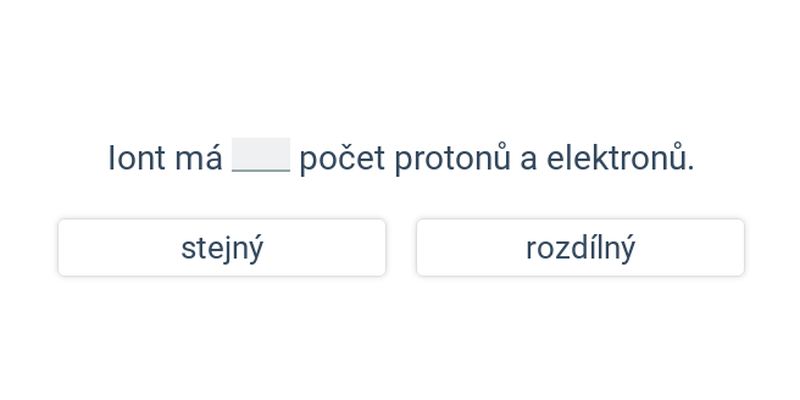
- Kationty jsou kladně nabité, počet elektronů v nich je nižší než počet protonů.
- Anionty jsou záporně nabité, počet elektronů v nich je vyšší než počet protonů.
Kation(t), anion(t)
V 1. pádu jednotného čísla se názvy iontů obvykle píší bez „t“ na konci (kation, anion), varianta s „t“ na konci je méně častá, ale také správně (kationt, aniont). Při skloňování či v množném čísle se ovšem „t“ ve slovech vyskytuje (kationtu, kationty).
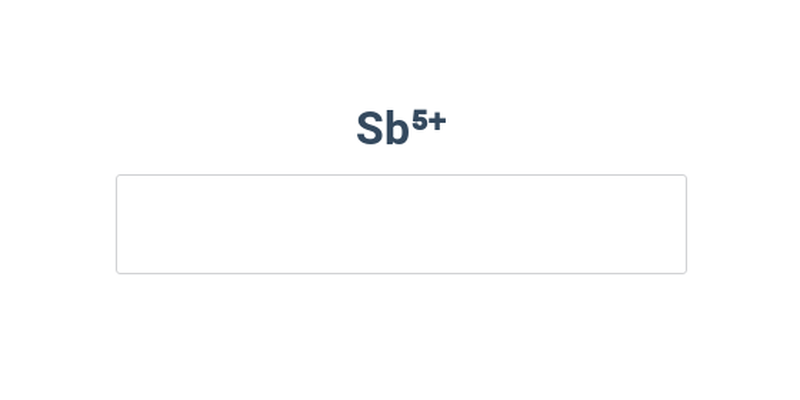
Náboj iontů se vyznačuje arabskou číslicí a znaménkem (nebo jen znaménkem) v horním indexu za značkou prvku. Např. \mathrm{Al^{3+}} = kation hlinitý. Oproti elektricky neutrálnímu atomu hliníku (13 elektronů) má o 3 elektrony méně (10 elektronů).
Při pojmenovávání kationtů se používají koncovky, které vyjadřují jejich náboj:
| Náboj iontu | Koncovka | Příklad |
|---|---|---|
| \mathrm{+} | -ný | \mathrm{Na^+} = kation sodný |
| \mathrm{2+} | -natý | \mathrm{Mg^{2+}} = kation hořečnatý |
| \mathrm{3+} | -itý | \mathrm{Fe^{3+}} = kation železitý |
Náboj × oxidační číslo iontů
- Oxidační číslo je myšlený (formální) náboj částice.
- U iontů vzniklých z jednotlivých atomů oxidační číslo obvykle odpovídá jejich reálnému náboji. V zásadě je tedy možné např. zaměňovat zápis \mathrm{Mg^{2+}} a \mathrm{Mg^{II}}.
- Pro hodnotu kladných oxidačních čísel a nábojů se také používají stejné názvoslovné koncovky.
Názvy jednoatomových aniontů končí na -idový, např. \mathrm{Cl^-} = anion chloridový. Anionty odvozené od kyslíkatých kyselin mají koncovku -anový, např. \mathrm{{SO_3}^{2-}} = anion siřičitanový.
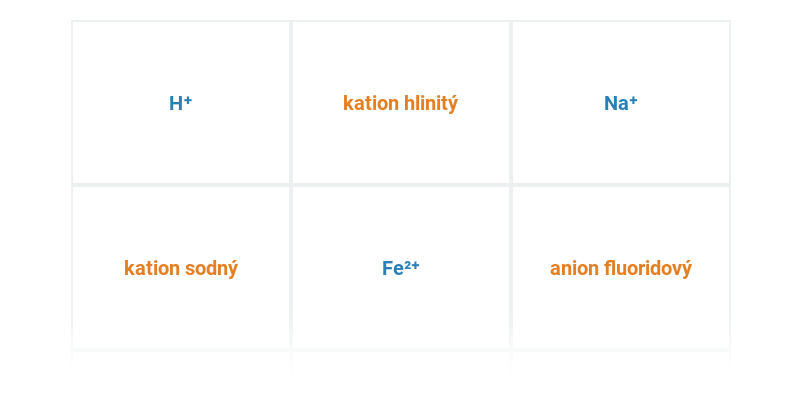
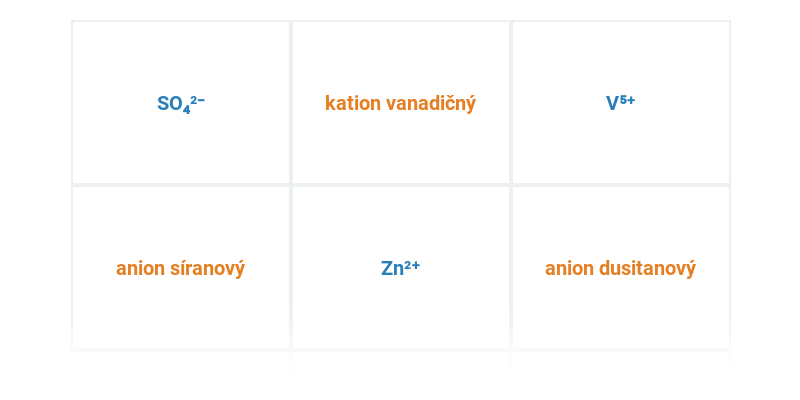
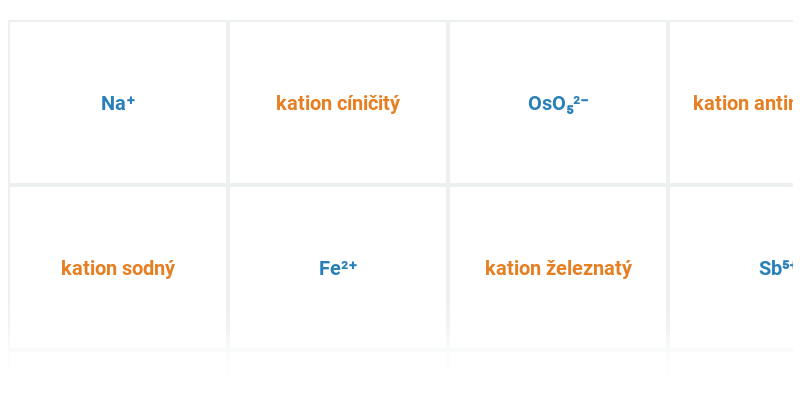
Poznávačka
Procvičování pojmů nebo názvů. Obsahuje dynamickou nápovědu.