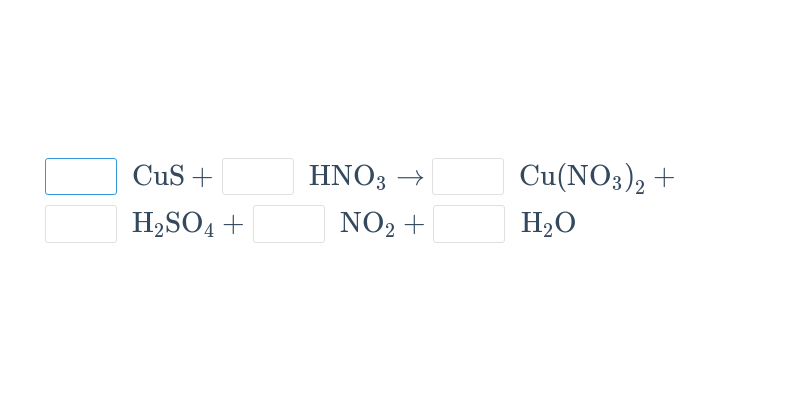
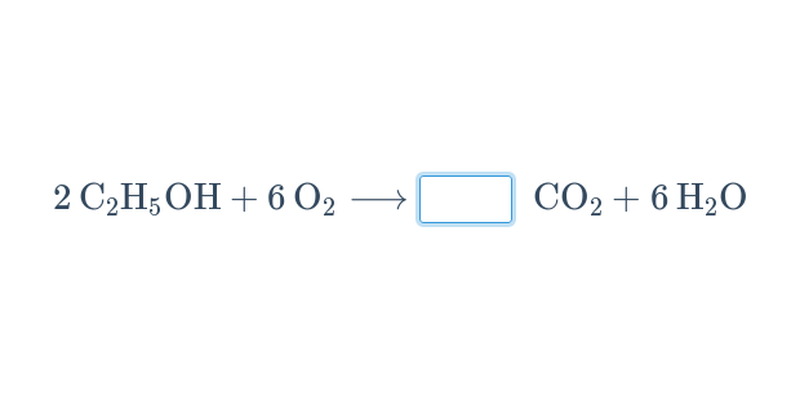
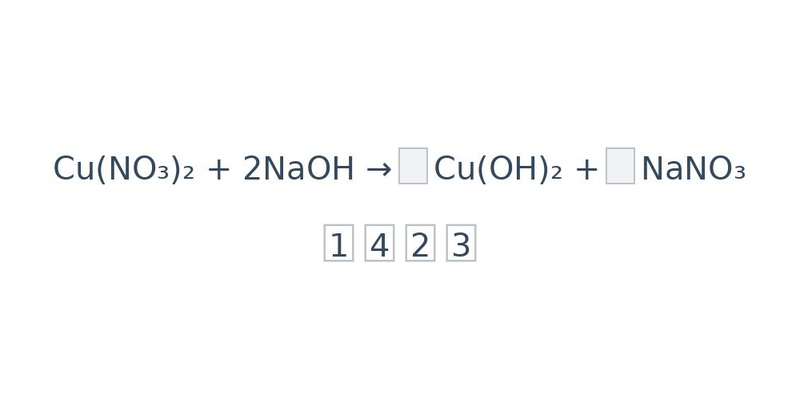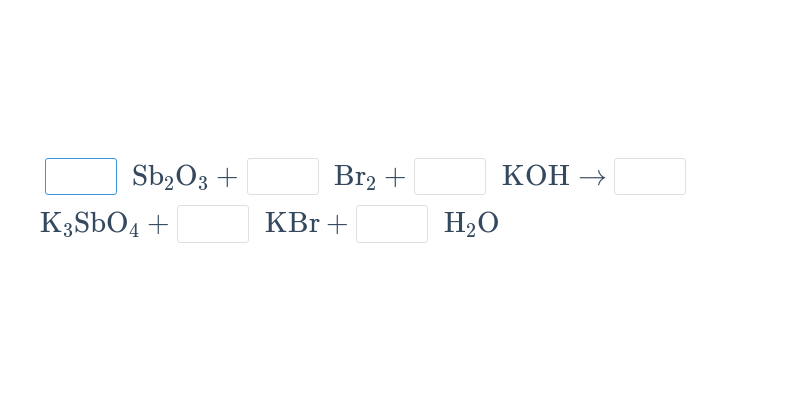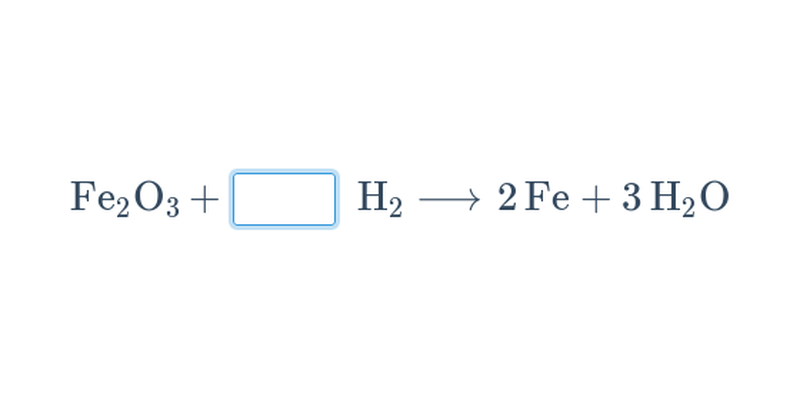Při chemických reakcích z výchozích látek vznikají produkty. Chemické reakce se popisují chemickými rovnicemi.
Zákon zachování hmotnosti
V rámci chemických reakcí dochází ke změnám chemických vazeb mezi částicemi (atomy/ionty). Částice samotné se ale nemění, jen se jinak přeskupí a navzájem navážou. Platí tedy zákon zachování hmotnosti: počet a typ částic v rámci výchozích látek odpovídá počtu a typu částic v produktech. Stejně tak hmotnost výchozích látek odpovídá hmotnosti produktů.
Vyčíslování rovnic
Mějme rovnici: \mathrm{Fe + O_2 \longrightarrow Fe_2O_3}
| Počet částic ve výchozích látkách | Počet částic v produktech |
|---|---|
| 1 atom železa (\mathrm{Fe}) 2 atomy kyslíku (\mathrm{O}) |
2 atomy železa (\mathrm{Fe}) 3 atomy kyslíku (\mathrm{O}) |
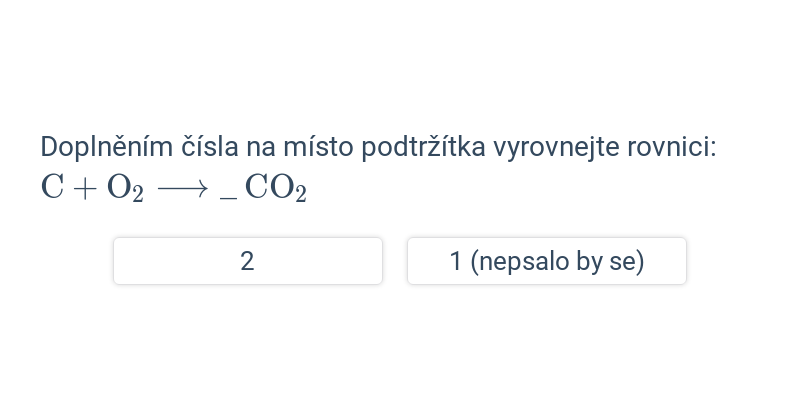
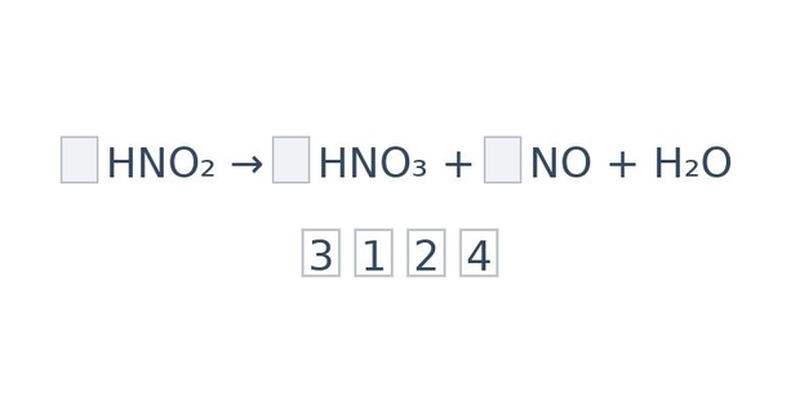
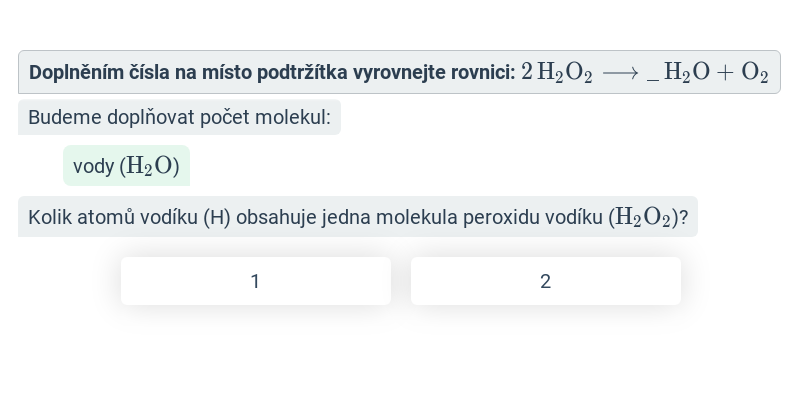
Zákon zachování hmotnosti výše není dodržen, rovnici je potřeba vyrovnat (vyčíslit) tak, aby si počty částic ve výchozích látkách a produktech odpovídaly. To se provede přidáním tzv. stechiometrických koeficientů. Stechiometrické koeficienty jsou čísla, která se píší před vzorce určitých látek v reakci. Popisují, v jakém poměru spolu určité látky reagují (co se týče látkového množství, nebo zkrátka počtu molekul/atomů). Je-li koeficient 1, obvykle se nepíše.
Vyrovnaná rovnice bude vypadat takto: \mathrm{4\;Fe + 3\;O_2 \longrightarrow 2\;Fe_2O_3}
| Počet částic ve výchozích látkách | Počet částic v produktech |
|---|---|
| 4 atomy železa (\mathrm{Fe}) 6 atomů kyslíku (\mathrm{O}) |
4 atomy železa (\mathrm{Fe}) 6 atomů kyslíku (\mathrm{O}) |
Rovnici je pak možné přečíst takto: 4 mol („díly“) železa reagují se 3 mol dvouatomových molekul kyslíku, vznikají 2 mol oxidu železitého.
Při vyrovnávání rovnic nezasahujeme do vzorců
Při vyrovnávání rovnic nelze upravovat samotné vzorce látek. Mohlo by tak dojít ke změně na vzorec zcela jiné (či nereálné) látky. Např. ze vzorce oxidu železitého výše nelze udělat vzorec neexistujícího „oxidu železičitého“ ().
Jak vyčíslovat rovnice
Při vyčíslování neredoxních rovnic je nutné postupně vyrovnávat množství jednotlivých prvků, případně si sestavit soustavu matematických rovnic.
Při vyčíslování redoxních rovnic lze vycházet z toho, že se mezi atomy myšleně přesune určité množství elektronů. Mějme nevyčíslenou reakci:
\mathrm{\overset{0}{P} + {H}\overset{V}{I}{O_3} + H_2O \longrightarrow {H_3}\overset{V}{P}{O_4} + H\overset{-I}{I}}
V rámci ní probíhají následující poloreakce. Aby bylo zajištěno zachování náboje, použijeme křížové pravidlo:
|
oxidace: \mathrm{\overset{0}{P} \longrightarrow \overset{V}{P} … 5\,e^-} redukce: \mathrm{\overset{V}{I} \longrightarrow \overset{-I}{I} … 6\,e^-} |
⤨ |
\overset{\phantom{I}}{6} \overset{\phantom{I}}{5} |
Získaná čísla zapíšeme před látky obsahující daný prvek: \mathrm{6\,P + 5\,HIO_3 + H_2O \longrightarrow 6\,H_3PO_4 + 5\,HI}
Nakonec rovnici dovyčíslíme, v tomto případě přidáním koeficientu ke vzorci vody: \mathrm{6\,P + 5\,HIO_3 + 9\,H_2O \longrightarrow 6\,H_3PO_4 + 5\,HI}
Rozhodovačka
Rychlé procvičování výběrem ze dvou možností.
Přesouvání
Přesouvání kartiček na správné místo. Jednoduché ovládání, zajímavé a neotřelé úlohy.
Krok po kroku
Doplňování jednotlivých kroků v rozsáhlejším postupu.
Vpisování
Cvičení, ve kterém píšete odpověď na klávesnici.