Pokud látce dodáváme, nebo odebíráme energii (např. ohříváme nebo ochlazujeme), může dojít ke změně jejího skupenství. Jednotlivé změny skupenství jsou znázorněny na diagramu níže:
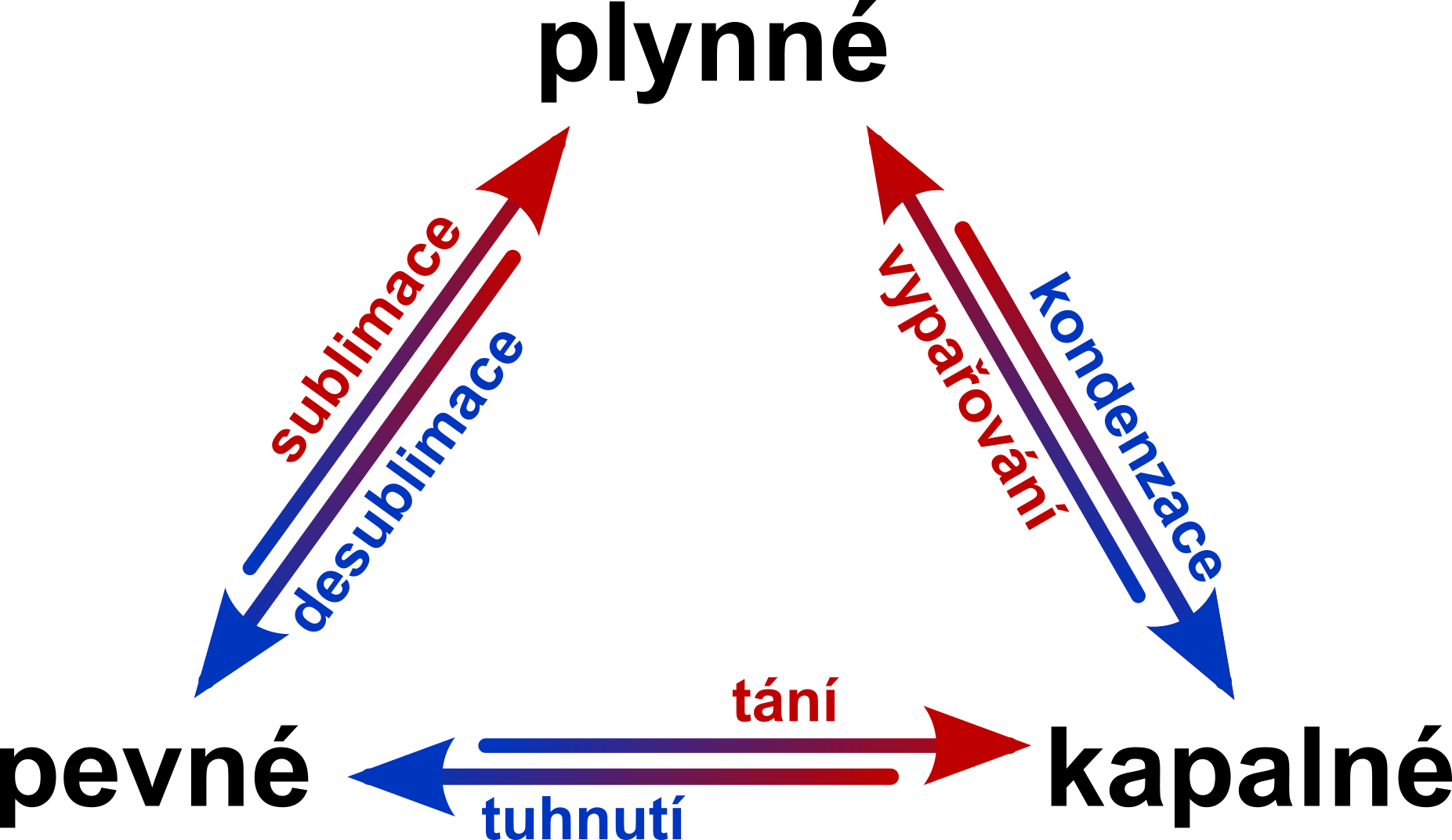
U přeměny kapaliny na plyn je dobře znám i pojem var. Jde o typ vypařování, kdy se kapalina přeměňuje na plyn v celém objemu (a ne pouze na svém okraji).
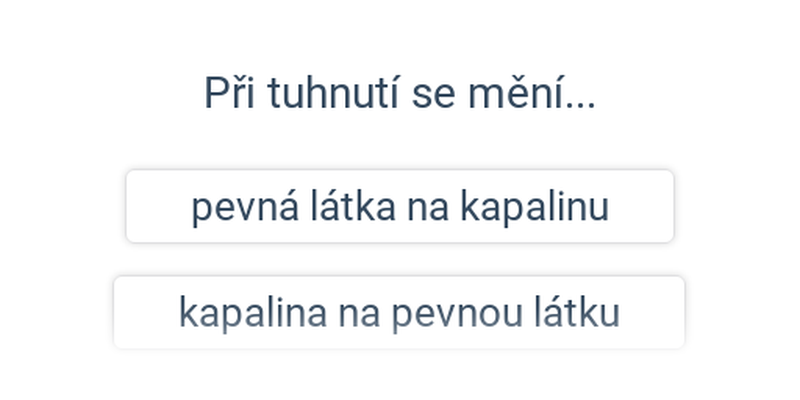
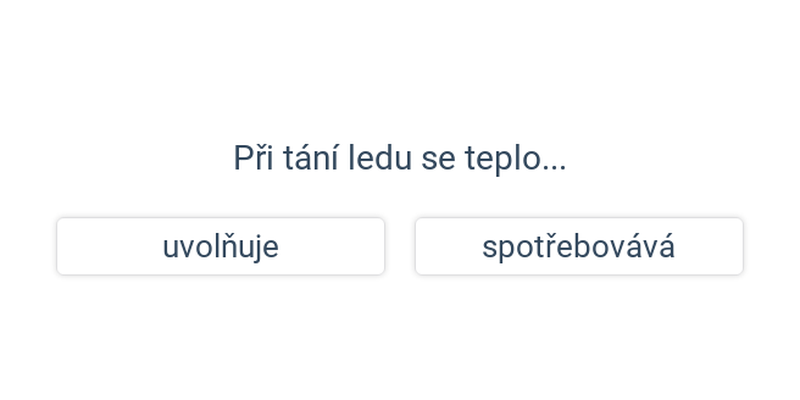
Tání, vypařování a sublimace spotřebovávají energii (musíme dodávat teplo). Při tuhnutí, kondenzaci a desublimaci se energie naopak uvolňuje. Tato energie souvisí se samotným procesem přeměny (ne se změnou teploty).
Příklad: od ledu k páře
Led (pevné) má −10 °C a zahříváme jej.
- Nejprve se ohřeje na teplotu tání 0 °C.
- Pak zůstává na 0 °C a teplo spotřebovává na přeměnu na vodu (tání).
- Tato voda (kapalné) se dále ohřívá až do 100 °C. Přitom se pomalu vypařuje.
- Zůstává na 100 °C a přeměňuje se na páru v celém objemu (var).
- Nakonec máme páru (plynné), která se může dále ohřívat (teoreticky neomezeně).
Pokud jde o plazma, to není skupenstvím v pravém slova smyslu, protože mezi plynem a plazmatem není ostrá hranice (změnu na plazma bychom ale mohli označit jako ionizaci plynu).
Zajímavosti
- Díky sublimaci cítíme například vůni pevného WC bloku.
- To, kdy nastane změna skupenství, je ve skutečnosti určeno jak teplotou, tak i okolním tlakem.
Rozhodovačka
Rychlé procvičování výběrem ze dvou možností.