V plynech může docházet (interakcí s okolím) k procesům, kdy se mění jednotlivé stavové veličiny. To je děj v plynu.
Během děje v ideálním plynu platí stavová rovnice pV=nRT. Pro uzavřené systémy (stálé množství plynu) je konstantní R i n a máme tři proměnné stavové veličiny (p, V a T).
Často dokážeme ještě jednu z nich zafixovat (například objem pevnou velikostí nádoby). Těmto nejjednodušším dějům s pouze dvěma proměnnými stavovými veličinami říkáme izochorický děj (stálý objem), izotermický děj (stálá teplota) a izobarický děj (stálý tlak).
Významným dějem je i adiabatický děj (u něj je konstantní tzv. entropie).
Izochorický děj (konstantní V)
Upravíme stavovou rovnici na \frac{p}{T}=\frac{nR}{V} (dělením obou stran výrazem VT). Pravá strana jsou samé konstanty, je tedy celá konstantní:
\frac{p}{T}=\mathrm{konst.}
Pro libovolné okamžiky (nebo stavy) 1 a 2 během tohoto děje tedy platí \frac{p_1}{T_1}=\frac{p_2}{T_2}. Jde vlastně o přímou úměru mezi p a T. Pokud se např. T postupně zdvojnásobuje, p současně roste také na dvojnásobek.
Izochorický děj v p-V diagramu
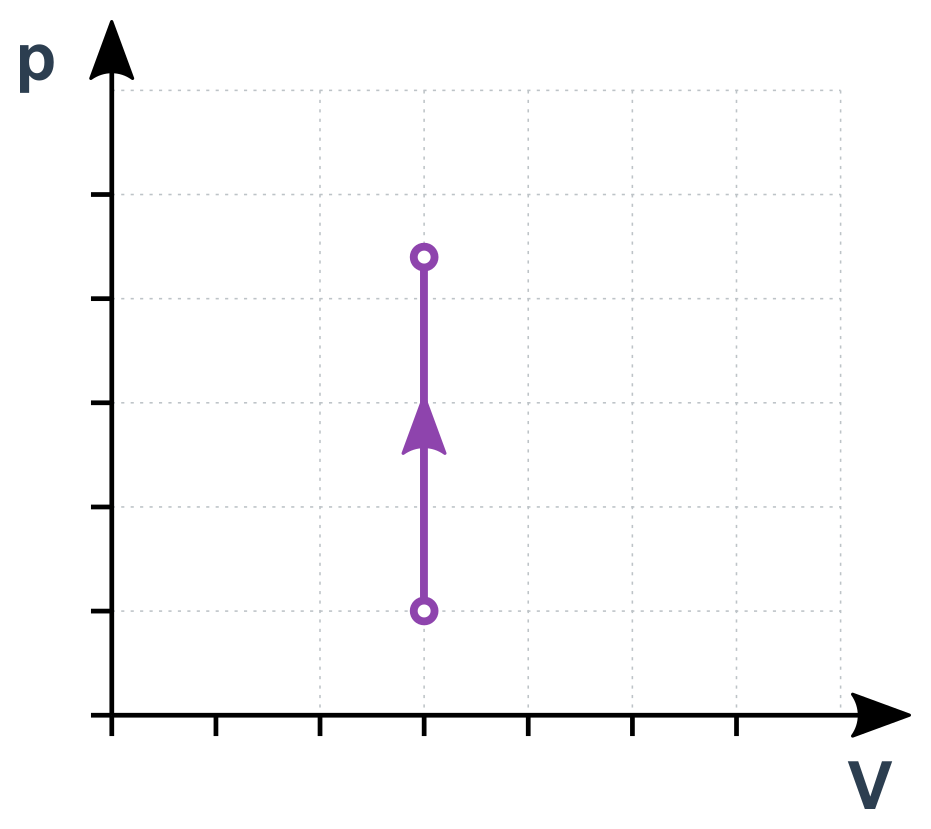
Izotermický děj (konstantní T)
Konstantou je T, a tedy i celá pravá strana stavové rovnice:
p\cdot V=\mathrm{konst.}
Pro dva stavy 1 a 2 platí p_1\cdot V_1=p_2\cdot V_2. Jde vlastně o nepřímou úměru mezi p a V (zvětšením V na dvojnásobek klesne p na polovinu). Změny musí probíhat dostatečně pomalu, aby “topení” stíhalo udržovat plyn na stálé teplotě. Jinak by šlo o jev adiabatický (viz níže).
Izotermický děj v p-V diagramu
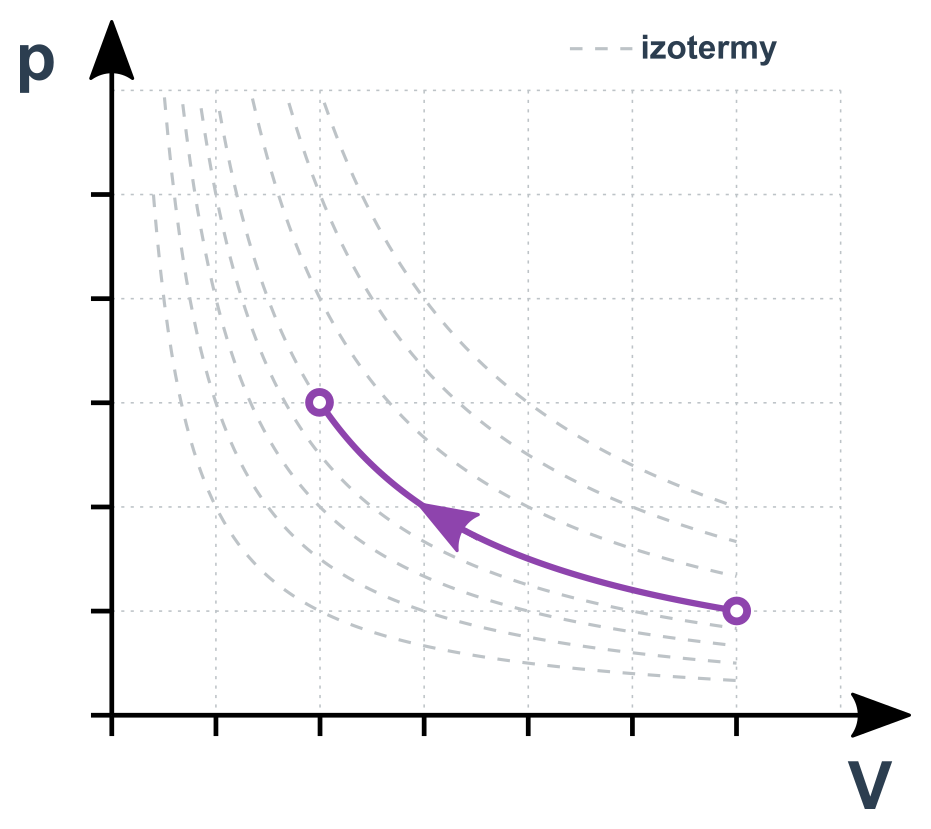
Izobarický děj (konstantní p)
Upravíme stavovou rovnici na \frac{V}{T}=\frac{nR}{p}. Pravá strana jsou opět samé konstanty, je tedy celá konstantní:
\frac{V}{T}=\mathrm{konst.}
Pro stavy 1 a 2 můžeme psát \frac{V_1}{T_1}=\frac{V_2}{T_2}. Jde vlastně o přímou úměru V a T. Pokud se T zdvojnásobí, V bude taky dvojnásobný).
Izobarický děj v p-V diagramu
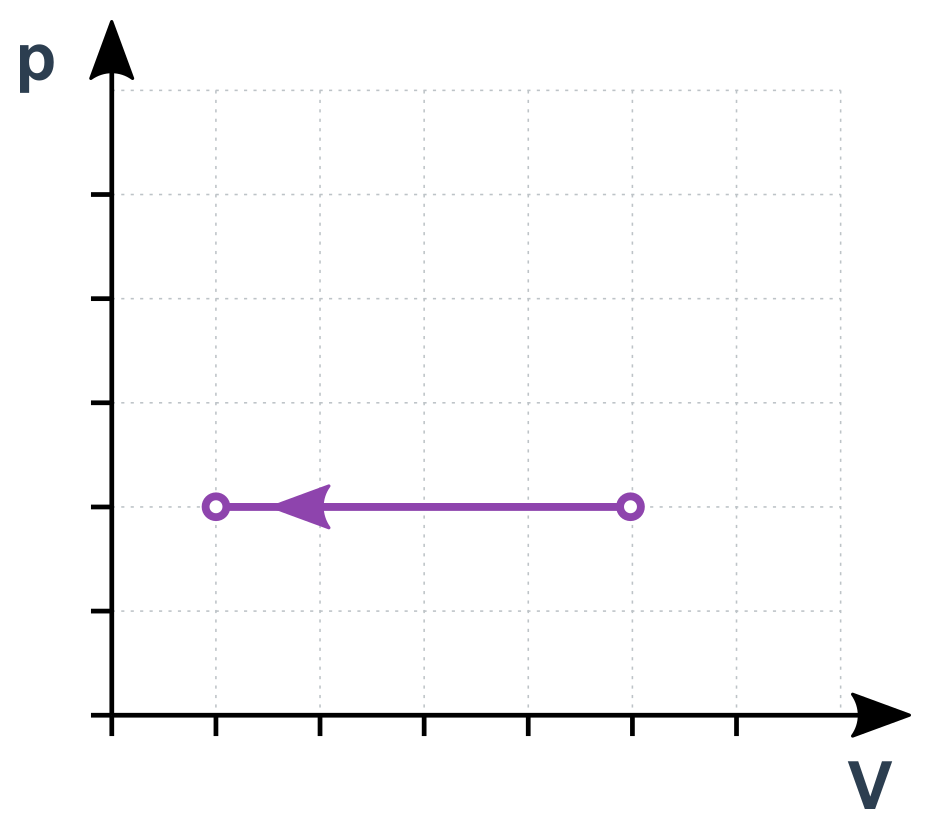
Adiabatický děj
Popisuje rychlou expanzi/stlačení plynu. Vztah uvádíme přímo:
p\cdot V^\kappa =\mathrm{konst.}
Pro jednoatomové plyny je \kappa=5/3, pro dvouatomové pak \kappa=7/5. Pro stavy 1 a 2 můžeme psát p_1\cdot V_1^{\kappa}= p_2\cdot V_2^{\kappa}.
Teplota při expanzi klesá (také proto deodoranty studí) a při stlačení roste (až ke vznícení paliva ve válci diesel motoru).
Adiabatický děj v p-V diagramu
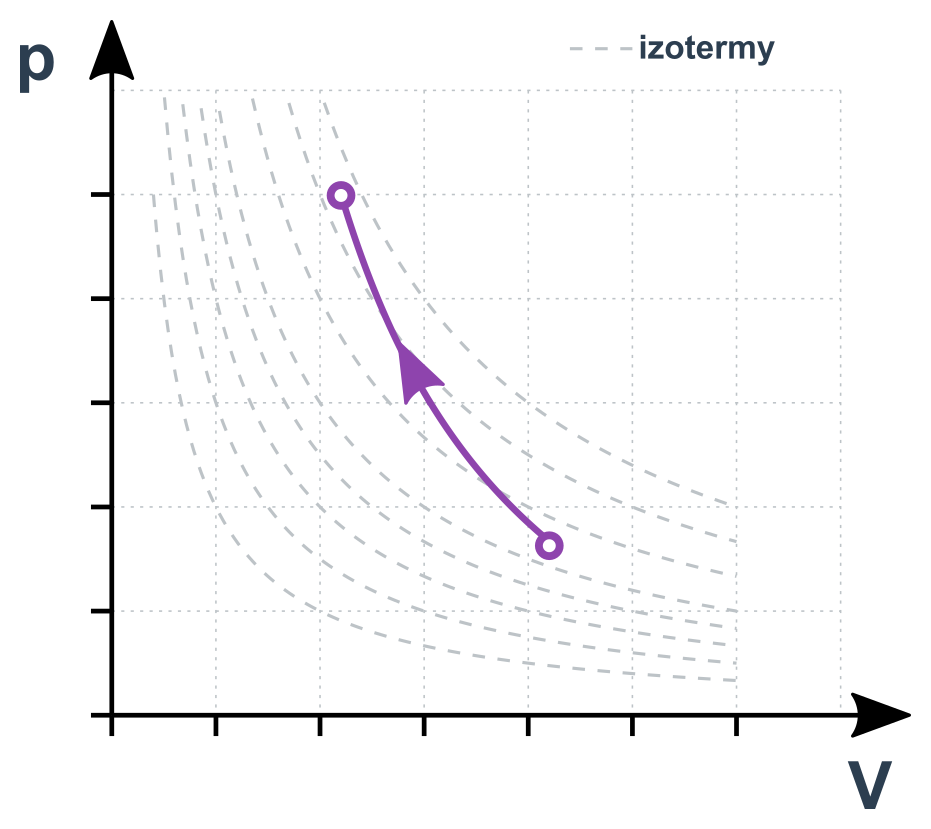
Zajímavosti
- Prakticky je nejsnáze dosažitelný děj izochorický (např. plyn uzavřený v pevné nádobě) a adiabatický (volná, rychlá nekontrolovaná expanze/stlačení).
- Pomocí p\cdot V^\kappa =\mathrm{konst.} a stavové rovnice pV=nRT můžeme vyjádřit pro adiabatický děj další vztah p\cdot T^{\frac{\kappa}{1-\kappa}}=\mathrm{konst.}
- Adiabatický děj (a pokles teploty při volném rozpínání) se používá k ochlazení zkapalňovaných plynů.
- Exponent \kappa je podíl měrného skup. tepla při stálém objemu a při stálém tlaku \kappa=c_\mathrm p/c_\mathrm V.
- Proč máme dvě verze stavové rovnice? Je to možné proto, že R byla definována jako R=k\cdot N_A a n = N/N_A (s Avogadrovou konstantou N_A). Po dosazení těchto výrazů za R a n do původní stavové rovnice p V = nRT získáme právě p V = NkT.













